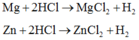Bài 1: Hỗn hợp A gồm 2 kim loại Mg và Zn, B la dung dịch \(H_2SO_4\) có nồng độ x mol/l.
- TN1: cho 24,3g A vào 2l dung dịch B, sinh ra 8,96l khí \(H_2\)( đktc)
- TN2: cho 24,3g A vào 3l dung dịch B, sinh ra 11.2l khí \(H_2\)( đktc)
a) Hãy chứng minh trong TN1 thì hỗn hợp kim loại chưa tan hết, TN2 axit còn dư.
b) Tính nồng độ x mol/l của dung dịch B và % về khối lượng mỗi kim loại trong A.
Bài 2: 1 oleum A có công thức là \(H_2SO_4.3SO_3\) . Cần bao nhiêu gam A để pha vào 100ml dung dịch \(H_2SO_4\) 40% (D=1,3kg/l) để tạo oleum có hàm lượng \(SO_3\) là 10%.
Bài 3: Hoàn thành các phản ứng sau:
(1) \(FeS_2+O_2\rightarrow\left(A\uparrow\right)+\left(B\right)\)
(2) \(\left(A\right)+H_2S\rightarrow\left(C\downarrow\right)+\left(D\right)\)
(3) \(\left(C\right)+\left(E\right)\underrightarrow{t}\left(F\right)\)
(4) \(\left(F\right)+HCl\rightarrow\left(G\right)+H_2S\)
(5) \(\left(G\right)+NaOH\rightarrow\left(H\downarrow\right)+\left(I\right)\)
(6) \(\left(H\right)+O_2+\left(D\right)\rightarrow\left(K\right)\)
(7) \(\left(K\right)\underrightarrow{t}\left(B\right)+\left(D\right)\)
(8) \(\left(B\right)+\left(L\right)\rightarrow\left(E\right)+\left(D\right)\)
Bài 4: Đốt cháy hoàn toàn 33,4g hỗn hợp B, gồm bột các kim loại Al, Fe và Cu ngoài không khí, thu được 41,4 g hổn hợp B2 gồm 3 oxit. Cho toàn bộ hỗn hợp B2 thu được tác dụng hoàn toàn với dung dịch \(H_2SO_4\) 20% có D= 1,14g/ml.
a) Viết các PTPỨ xảy ra.
b) Tính thể tích tối thiểu của dung dịch \(H_2SO_4\) 20% để hòa tan hết hỗn hợp B2.
Bài 5: Chỉ được sử dụng 1 dung dịch chứa 1 chất tan để nhận biết các dung dịch muối sau: \(Al\left(NO_3\right)_3,\left(NH_4\right)_2SO_4,NaNO_3,NH_4NO_3,MgCl_2,FeCl_2\)đựng trong các lọ riêng biệt bị mất nhãn. Viết PTPỨ.
Bài 6: Hoàn thành các phản ứng sau:
(1) \(H_2S+O_2\underrightarrow{t}A\left(rắn\right)+B\left(lỏng\right)\)
(2) \(\left(A\right)+O_2\underrightarrow{t}\left(C\right)\)
(3) \(HCl+MnO_2\rightarrow\left(D\uparrow\right)+\left(E\right)+\left(B\right)\)
(4) \(\left(B\right)+\left(C\right)+\left(D\right)\rightarrow\left(F\right)+\left(G\right)\)
(5) \(\left(G\right)+Ba\rightarrow\left(H\right)+\left(I\uparrow\right)\)
(6) \(\left(D\right)+\left(I\right)\rightarrow\left(G\right)\)
(7) \(\left(F\right)+Cu\rightarrow\left(K\right)+\left(B\right)+\left(C\right)\)
(8) \(\left(K\right)+\left(H\right)\rightarrow\left(L\downarrow\right)+\left(M\right)\)
(9) \(\left(M\right)+\left(F\right)\rightarrow\left(K\right)+\left(G\right)\)