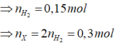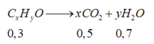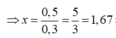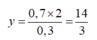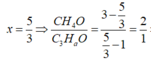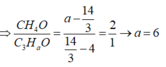Có 2 hỗn hợp sau:
- Hỗn hợp A gồm 11,2 gam sắt và 3,25 gam kẽm.
- Hỗn hợp B gồm 2,7 gam nhôm và 4,8 gam magie.
Hỏi:
- Hỗn hợp nào nặng hơn?
- Hỗn hợp nào chứa nhiều mol nguyên tử hơn?
- Hỗn hợp nào chứa nhiều nguyên tử hơn?
Mình cần gấp nhe , mn gửi nhanh nhá