Cho 10,8 l khí Cl2 ở đktc TD với m(g) Cu. Sau PỨ thu được 63.9g chất rắn
a, Chất nào hết , dư
b, Tinh m và % klg các chất sau PỪ
giúp vvs!!!!!!!!!!!!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cu+Cl2->CuCl2
Bài này cũng dễ mà sao bạn cho số không đẹp tí nào zậy, rắc rối

PTHH: Cu + Cl2 -to-> CuCl2
Ta có: \(n_{Cl_2}=\frac{10,8}{22,4}\approx0,482\left(mol\right)\\ n_{CuCl_2}=\frac{63,9}{135}\approx0,473\left(mol\right)\)
Theo PTHH và đề bài, ta có:
\(\frac{0,482}{1}>\frac{0,473}{1}\)
=> Cl2 dư , Cu hết nên tính theo nCu
Theo PTHH và đề bài, ta có:
\(n_{CuCl_2}=n_{Cu}=0,473\left(mol\right)\)
b) Khối lượng CuCl2:
\(m_{CuCl_2}=0,473.135=63,855\left(g\right)\)
=> \(\%Cu=\frac{64}{135}.100=47,407\%\)
\(\%Cl=100\%-47,407\%=52,593\%0\)

Chọn B
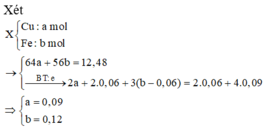
Khi cho X tác dụng với HNO3 thu được dung dịch T gồm Fe(NO3)2 (x); Fe(NO3)3 (y); Cu(NO3)2 (0,09).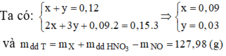
Vậy C% Fe(NO3)3 = 5,67%

câu 1: nAl=0,4 mol
mHCL=54,75g=> nHCl=1,5 mol
PTHH: 2Al+6HCl=> 2AlCl3+3H2
0,4mol: 1,5mol => nHCl dư theo nAl
0,4mol-->1,2 mol-->0,4mol-->0,6mol
thể tích H2 là V=0,6.22,4=13,44ml
b) theo định luật btoan khối lượng ta có : mAlCl3=200+10,8-0,6.2=209,6g
m AlCl3=0,4.(27+35,5.3)=53,4g
=> C% AlCl3= 25,48%
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2 ↑
Khối lượng chất tan HCl là:
200 . 27,375% = 54,75(gam)
Số mol của HCl là: 54,75 : 36,5 = 1,5 (mol)
Số mol của Al là: 10,8 : 27 = 0,4 (mol)
So sánh: \( {0,4{} \over 2}\) < \({1,5} \over 6\)
=> HCl dư, tính theo Al
Số mol của khí hiđrô sinh ra là: 0,4 . \(3 \ \over 2\) = 0,6 (mol)
V= 0,6 . 22,4 = 13,44 (lít)
Sau đó áp dụng định luật bảo toàn khối lượng để tính khối lượng dung dịch A:
Khối lượng nhôm + Khối lượng dung dịch axit
= Khối lượng dung dịch A + khối lượng khí hiđrô
<=> Khối lượng dung dịch A là:
10,8 + 200 - 0,6 . 2 = 209,6 (gam)
Khối lượng chất tan AlCl3 trong dung dịch A là:
0,4 . 133,5 = 53,4 (gam)
C% chất tan trong dung dịch A là:
( 53,4 : 209,6 ) . 100% = 25,48%

2Al+6HCl---->2AlCl3+3H2
Al2o3+6HCl--->2AlCl3+3H2O
Cu+HCl--> không p/u
2Cu + O2---->2CuO
ncuO=2,75/80=0.034375(mol)
Cứ 2 mol Cu---à 2 mol CuO
0.034375<------0.034375
mCu=0,034375.64=2,2(g)
--->%mCu=2,2.100/10=22%
nH2=3,36/22,4=0,15(mol)
cứ 2 mol Al----->3 mol H2
0.1<-----0.15
mAl :0,1.27=2.7(g)
--->%mAl=2,7.100/10=27%
---->%mAl2o3=100%-27%-22%=51%

Khi nhiệt phân KMnO4, phần khí O2 sinh ra bay hơi nên lượng chất rắn còn lại gồm KMnO4 dư, K2MnO4 và MnO2. Dựa vào định luật bảo toàn khối lượng dễ dàng tìm được khối lượng O2. Xét sự thay đổi số oxi hóa của các nguyên tố trong toàn bộ quá trình, chỉ có Mn, O và Cl thay đổi số oxi hóa. Dựa vào định luật bảo toàn electron với số mol Mn và O đã biết ta suy ra được số mol electron Cl- đã nhận.
Chất rắn bao gồm K2MnO4 và MnO2
BTKL:
Khi cho chất rắn phản ứng với HCl sẽ xảy ra phản ứng oxi hóa – khử.
Khí X chính là Cl2.
Sử dụng định luật bảo toàn electron cho toàn bộ quá trình, ta có các bán phản ứng:
Phản ứng điều chế clorua vôi CaOCl2:
Khối lượng clorua vôi theo lý thuyết:
Clorua vôi này chứa 30% tạp chất tức là clorua vôi nguyên chất chỉ chiếm 70%.
Khối lượng clorua vôi thực tế thu được:
a, PTHH : \(Cl_2+Cu\rightarrow CuCl_2\)
\(n_{Cl_2}=\dfrac{V}{22.4}=\dfrac{10,8}{22,4}=0,48\left(mol\right)\)
\(n_{CuCl_2}=\dfrac{m}{M}=\dfrac{63,9}{135}=0,47\left(mol\right)\)
PTHH : \(Cl_2+Cu\rightarrow CuCl_2\)
TheoPTHH : 1 mol → 1mol
Theo baì : 0,48 mol → 0,47 mol
Tỉ lệ : \(\dfrac{0,48}{1}>\dfrac{0,47}{1}\)
=> Cl2 dư , \(CuCl_2\) hết
Bạn có thể giúp mk bài này vs dk k