cho 21,6g hỗn hợp 3 kim loại Zn, Fe, Cu trong dung dịch H2SO4 loãng, dư. Phản ứng xong, thu được 3g chất rắn không tan và 6,72l khí(đktc)
a. viết PTHH
b. xác định thành phần % của mỗi kim loại có trong hộn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)Zn +H2SO4 -> ZnSO4 +H2
Fe +H2SO4 -> FeSO4 +H2
Cu +H2SO4 -> CUSO4+H2
đặt số mol 3 KL Zn, Fe, Cu lần lượt là a, b, c (mol), ta có pt theo đề bài:
65a+56b+64c=21.6 (1)
c=3/64 (2)
a+b=6.72/22.4 (3)
Từ (1)(2)(3)==> a=0.2(mol), b=0.1(mol), c=3/64(mol)
==>%Zn=0.2 x 65 x100/21.6 = 60.185%
%Fe=0.1 x 56 x 100/21.6 = 25.925%
%Cu=100%-( 60.185% + 25.925% )= 13.89%

phương trình bn tự ghi nha:
đặt số mol 3 KL Zn, Fe, Cu lần lượt là a, b, c (mol), ta có pt theo đề bài:
65a+56b+64c=21.6 (1)
c=3/64 (2)
a+b=6.72/22.4 (3)
Từ (1)(2)(3)==> a=0.2(mol), b=0.1(mol), c=3/64(mol)
==>%Zn=0.2x65x100/21.6=60.185%
%Fe=0.1x56x100/21.6=25.925%
%Cu=100%-(60.185%+25.925%)=13.89%

a, \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
mhh Zn và Fe = 21,6-3 = 18,6 (g)
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: x x
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}65x+56y=18,6\\x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\%m_{Zn}=\dfrac{0,2.65.100\%}{21,6}=60,19\%\)
\(\%m_{Fe}=\dfrac{0,1.56.100\%}{21,6}=25,93\%\)
\(\%m_{Cu}=100-60,19-25,93=13,88\%\)
b,
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: 0,2 0,2 0,2
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: 0,1 0,1 0,1
\(m_{H_2SO_4}=\left(0,1+0,2\right).98=29,4\left(g\right)\Rightarrow m_{ddH_2SO_4}=\dfrac{29,4.100\%}{25\%}=117,6\left(g\right)\)
c,mdd sau pư = 21,6+117,6- (0,1+0,2).2 = 138,6 (g)
\(C\%_{ddZnSO_4}=\dfrac{0,2.161.100\%}{138,6}=23,23\%\)
\(C\%_{ddFeSO_4}=\dfrac{0,1.152.100\%}{138,6}=10,97\%\)

3g chất rắn không tan là Cu
=> \(m_{Zn}+m_{Fe}=18,6\left(g\right)\)
Theo đề bài ta có PTHH:
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\) (I)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\) (II)
Gọi \(n_{Zn}=x\left(mol\right);n_{Fe}=y\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}65x+56y=18,6\\x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=56\cdot0,1=5,6\left(g\right)\) ; \(m_{Zn}=65\cdot0,2=13\left(g\right)\)
\(\%m_{Fe}=\dfrac{5,6}{21,6}\cdot100\%=25,93\left(\%\right)\)
\(\%m_{Zn}=\dfrac{13}{21,6}\cdot100\%=60,19\left(\%\right)\)
\(\%m_{Cu}=\left(100-25,93-60,19\right)\%=13,88\%\)

a) Đặt: nZn=x(mol); nFe= y(mol) (x,y: nguyên, dương)
Zn + H2SO4 -> ZnSO4 + H2
x_______x_______x________x
Fe + H2SO4 -> FeSO4 + H2
y____y_________y___y(mol)
b) m(rắn)=mCu=3(g)
=> m(Zn, Fe)= 21,6 - 3= 18,6(g)
Ta có hpt:
\(\left\{{}\begin{matrix}65x+56y=18,6\\22,4x+22,4y=6,72\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
=> Zn= 65.0,2=13(g)
=>%mZn= (13/21,6).100=60,185%
%mCu=(3/21,6).100=13,889%
=>%mFe=25,926%
c) nH2SO4=x+y=0,3(mol) =>mH2SO4=29,4(g)
=> mddH2SO4= (29,4.100)/25=117,6(g)

Đặt nZn = x mol; nFe = y mol.
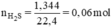
Ta có hệ phương trình: 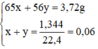
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Zn+ H2SO4→ ZnSO4+ H2↑
(mol) 0,1 0,1 0,1
a)
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{2,24}{22,4}=0,1\left(lít\right)\)
→mZn=n.M=0,1.65= 6,5(g)
→mCu= 10- 6,5= 3,5(g)
=> \(\%m_{Zn}=\dfrac{6,5}{10}.100\%=65\%\)
\(\%m_{Cu}=100\%-65\%=35\%\)
b) \(C_{M_{H_2SO_4}}=\dfrac{n}{V}=\dfrac{0,1}{0,1}=1M\)

a)Thí nghiệm 2 :
$2R + O_2 \xrightarrow{t^o} 2RO$
n O2 = 1,12/22,4 = 0,05(mol)
n R < 2 n O2 = 0,1(mol)
=> R > 3/0,1 = 30(1)
Thí nghiệm 2 : n H2 = 5,6/22,4 = 0,25(mol)
n R = a(mol)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$R + H_2SO_4 \to RSO_4 + H_2$
n Fe = 0,25 - a(mol)
Suy ra :
(0,25 - a).56 + Ra = 11,6
=> R = (56a - 2,4)/a
Mà 0 < a < 0,25
Suy ra : R < 46,6(2)
Từ (1)(2) suy ra : 30 < R < 46,6
Suy ra R là Ca(R = 40)
b) (0,25 -a)56 + 40a = 11,6
=> a = 0,15
%m Ca = 0,15.40/11,6 .100% = 51,72%
%m Fe = 100% -51,72% = 48,28%
_ Gọi a,b lần lượt là số mol của Zn, Fe (a,b > 0)
_ PTHH:
Zn + H2SO4 -> ZnSO4 + H2
a mol__ a mol ___ a mol ____ a mol
Fe + H2SO4 -> FeSO4 + H2
b mol__ b mol_____ b mol ___ b mol
_ Vì sau pư thu đc 3g chất rắn ko tan nên mCu = 3 g.
_ mhh = 21,6 \(\Rightarrow m_{Zn}+m_{Fe}+m_{Cu}=21,6\)
\(\Rightarrow65a+56b=18,6\) (1)
_ \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\) (mol)
=> a + b = 0,3 (2)
Từ (1) và (2) => a = 0,2; b = 0,1
=> mZn = 0,2 . 65 = 13(g)
=> %mZn = \(\dfrac{13}{21,6}.100\%=60,18\%\)
Khi đó: mFe = 0,1 . 56 = 5,6 (g)
=> %mFe = \(\dfrac{5,6}{21,6}.100\%=\) 25,92 %
=> %mCu = \(13,9\%\)