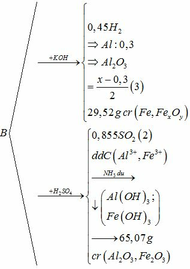
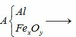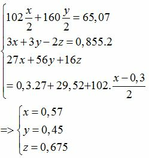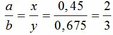Bài 1:Hòa tan hoàn toàn một oxit sắt của dd H2SO4 loãng dư thu được dd X. Chia X ra làm nhiều phần nhỏ có thành phần tương đương nhau
Phần 1: Cho bột Cu vào thấy bột Cu tan
a) Cho biết oxit sắt là oxit nào. Viết PTHH nếu có
b) Lấy các phần nhỏ của X cho tác dụng lần lượt với các chất, dd sau: Fe, Cl2, dd Na2CO3, dd NaNO3. Viết PTHH nếu có
Bài 2: Hòa tan hoàn toàn m gam hỗn hợp A gồm Na, Ba, BaO, Na2O, vào nước dư thu được dd X có chứa 0,15mol Ba(OH)2 và 3,36lít H2 (đktc). Hấp thụ hoàn toàn 0,49mol CO2 vào dd X. Thu được 21,67gam kết tủa và dd Y
a) Xác định m
b) Cô cạn Y đến khi phản ứng kết thúc thu được m gam muối khan. Tính m
c) Nếu thêm V lít dd Ca(OH)2 0,02M vào \(\dfrac{1}{10}\) dd Y thì giá trị nhỏ nhất của V là bao nhiêu để thu được lượng kết tủa lớn nhất
Bài 3: dd hỗn hợp Y chứa Na2CO3 1M, NahCO3 0,5M cho từ từ đến hết 200ml dd HCl 1M vào 100ml dd Y thu được V lít CO2
a) Viết PTHH và tính V, các phản ứng trên xảy ra hoàn toàn
b) Nếu đổ từ từ đến hết 100ml dd Y vào 200ml dd HCl 1M ở trên thì sau khi phản ứng xảy ra hoàn toàn thu được tối đa bao nhiêu lít CO2