Câu 1: Một hỗn hợp A gồm Ba và Al.
Cho m gam A tác dụng với nước dư, thu được 1,344 lít khí, dung dịch B và một phần không tan C.
Cho 2m gam A tác dụng với dung dịch Ba(OH)2 dư thu được 20,832 lít khí. (Các phản ứng đều xảy ra hoàn toàn, các thể tích khí đo ở điều kiện tiêu chuẩn).
a) Tính khối lượng từng kim loại trong m gam A.
b) Cho 50 ml dung dịch HCl vào dung dịch B. Sau khi phản ứng xong, thu được 0,78 gam kết tủa. Xác định nồng độ mol/lít của dung dịch HCl.
các đại cao nhân giúp em , :(( chiều em nộp r


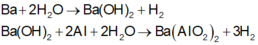
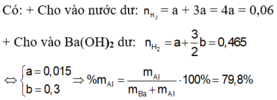

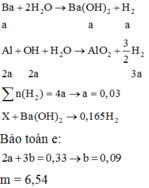

chào chị
Chào chị