Cho 10 lít khí H2 tác dụng với 6,72 liwts Cl2 (đktc ) . Tính khối lượng của HCl thu được , biết hiệu suất phản ứng là 60% và mất mát là 5 %
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Em kiểm tra lại đề nhé. Dữ kiện mất mát 5% hơi mẫu thuẫn. Vì hiệu suất có là 60% nên lượng mất mát đã là 40% rồi

PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{Al\left(LT\right)}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\\n_{HCl\left(LT\right)}=2n_{H_2}=0,6\left(mol\right)\end{matrix}\right.\)
Mà: H% = 80%
\(\Rightarrow\left\{{}\begin{matrix}n_{Al\left(TT\right)}=\dfrac{0,2}{80\%}=0,25\left(mol\right)\\n_{HCl\left(TT\right)}=\dfrac{0,6}{80\%}=0,75\left(mol\right)\end{matrix}\right.\)
⇒ mAl = 0,25.27 = 6,75 (g)
mHCl = 0,75.36,5 = 27,375 (g)

\(H_2+Cl_2\left(0,18\right)\rightarrow2HCl\left(0,36\right)\)
\(n_{H_2}=\frac{10}{22,4}\approx0,446\left(mol\right)\)
\(n_{Cl_2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
Vì \(\frac{n_{H_2}}{1}=0,446>\frac{n_{Cl_2}}{1}=0,3\) nên ta tính HCl theo Cl2
Số mol Cl2 tham gia phản ứng là: \(0,3.60\%=0,18\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,36.36,5=13,14\left(g\right)\)
\(\Rightarrow m_{HCl\left(conlai\right)}=13,14.\left(100\%-5\%\right)=12,483\left(g\right)\)

\(n_{AgCl}=\dfrac{43.05}{143.5}=0.3\left(mol\right)\) \(\Rightarrow n_{HCl}=0.3\left(mol\right)\)
\(n_{HCl}=\dfrac{6.72}{22.4}=0.3\left(mol\right),n_{Cl_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(H_2+Cl_2\underrightarrow{^{^{t^0}}}2HCl\)
\(0.15....0.15.......0.3\)
\(H\%=\dfrac{0.15}{0.2}\cdot100\%=75\%\)

\(n_{AgCl}=\dfrac{7,175}{143,5}=0,05\left(mol\right)\)
PTHH: HCl + AgNO3 ---> AgCl↓ + HNO3
0,05<---------------0,05
\(\rightarrow m_{HCl}=0,05.36,5=1,825\left(g\right)\\
\rightarrow C\%_{ddA}=\dfrac{1,825}{50}.100\%=3,65\%\)
\(n_{Cl_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Đặt H = x%
PTHH: Cl2 + H2 --as--> 2HCl
LTL: 6,72 < 10 => H2 dư
=> nHCl = 0,3x (mol)
\(\rightarrow C\%_{HCl}=\dfrac{0,3x.36,5}{0,3x.36,5+385,4}.100\%=3,65\%\\ \Leftrightarrow20,23\%\)

$N_2 + 3H_2 \buildrel{{t^o,xt,p}}\over\rightleftharpoons 2NH_3$
Ta thấy : $V_{N_2} : 1 > V_{H_2} : 3$ nên $N_2$ dư
Gọi hiệu suất là a
Suy ra : $V_{H_2\ pư} = 11,2a(lít)$
$V_{N_2\ pư} = \dfrac{11,2a}{3}$
$V_{NH_3} = \dfrac{2.11,2a}{3} $
Ta có :
$11,2 - 11,2a + 6,72 - \dfrac{11,2a}{3} + \dfrac{2.11,2a}{3} = 13,44$
$\Rightarrow a = 0,6 =6 0\%$
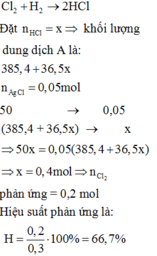
\(PTHH: H_2 + Cl_2 ---> 2HCl \)
\(nH2 = \dfrac{10}{22,4}=\dfrac{25}{56} (mol)\)
\(nCl2 = \dfrac{6,72}{22,4} = 0,3(mol)\)
So sánh: \(\dfrac{nH2}{1} > \dfrac{nCl2}{1}\)
=> Chọn \(nCl2 \) để tính
Theo PTHH: \(nHCl = 2.nCl = 2.0,3 = 0,6(mol)\)
\(=> mHCl \)(lí thuyết) \( = 0,6.36,5 = 21,9 (mol)\)
Vì H = 60%
\(=> mHCl \)thực tế = \(\dfrac{21,9.60}{100} = 13,14 (g)\)
Vì mất mát 5%
=> mHCl = 13,14 - \(\frac{13,14.5}{100}\) = 12,483 (g)