Ngâm một vật bằng Cu có kl10g trong 250g dung dịch AgNO3 4%. Khi lấy vạt ra thì lượng AgNO3 trong dung dịch giảm 17%. Tinh kl vật sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khối lượng vật sau phản ứng = 10 + 0,01 x 108 – 0,005 x 64 = 10,76 g

\(n_{AgNO_3}=\dfrac{250.4}{100.170}=\dfrac{1}{17}\left(mol\right)\)
=> \(n_{AgNO_3\left(pư\right)}=\dfrac{1}{17}.17\%=0,01\left(mol\right)\)
PTHH: Cu + 2AgNO3 --> Cu(NO3)2 + 2Ag
____0,005<--0,01--------------------->0,01
=> m = 12 - 0,005.64 + 0,01.108 = 12,76(g)
=> A

2AgNO3 + Cu → Cu(NO3)2 + 2Ag
Phương trình ion thu gọn: Cu + 2Ag+ → Cu2+ + 2Ag↓
AgNO3 là chất oxi hóa, Cu là chất khử.
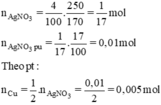
Áp dụng tăng giảm khối lượng

Khối lượng của AgNOg trong dung dịch là:
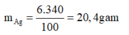
Phương trình phản ứng xảy ra:
![]()
Cứ 1 mol Cu phản ứng với 2 mol AgNO3, sinh ra 1 mol Cu(NO3)2 và 2 mol Ag, khối lượng kim loại tăng
![]()
Khối lượng AgNO3 đã tham gia phản ứng:
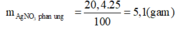
Từ (1)=> Số mol Cu đã phản ứng:
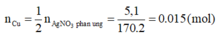
=> Khối lượng của vật sau phản ứng: m = 15 + 152.0,015 = 17,28 (gam).
Đáp án B.

PT: \(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
a, m AgNO3 (pư) = 250.17%.6% = 2,55 (g)
\(\Rightarrow n_{AgNO_3\left(pư\right)}=\dfrac{2,55}{170}=0,015\left(mol\right)\)
Theo PT: nCu (pư) = 1/2nAgNO3 = 0,0075 (mol)
nAg = nAgNO3 = 0,015 (mol)
⇒ m vật lấy ra = 50 - mCu (pư) - mAg = 51,14 (g)
b, Ta có: m dd sau pư = 0,0075.64 + 250 - 0,015.108 = 248,86 (g)
Theo PT: nCu(NO3)2 = 1/2nAgNO3 = 0,0075 (mol)
\(\Rightarrow C\%_{Cu\left(NO_3\right)_2}=\dfrac{0,0075.188}{248,86}.100\%\approx0,57\%\)
\(C\%_{AgNO_3}=\dfrac{250.6\%-2,55}{248,86}.100\%\approx5\%\)

a./ Khối lượng AgNO3 trong dd ban đầu: m(AgNO3) = 250.6% = 15g
Khối lượng AgNO3 pư: m(AgNO3 pư) = 17%.15 = 2,55g
→ n(AgNO3) = 2,55/170 = 0,015mol
2AgNO3 + Cu → 2Ag + Cu(NO3)2
0,015___0,0075_0,015__0,0075
Khối lượng của vật lấy ra sau pư:
m = 50 + m(Ag) - m(Cu pư) = 50 + 0,015.108 - 0,0075.64 = 51,14g
b./ Khối lượng các chất có trong dd sau pư:
m[Cu(NO3)2] = 0,0075.188 = 1,41g
m(AgNo3 dư) = m(AgNO3) - m(AgNO3 pư) = 15 - 2,55 = 12,45g
Khối lượng dd thu được:
m(dd) = m(dd AgNO3) + m(Cu pư) - m(Ag) = 250 + 0,0075.64 - 0,015.108 = 248,86g
Thành phần % các chất có trong dung dịch
%AgNO3 dư = 12,45/248,86 .100% = 5%
%Cu(NO3)2 = 1,41/248,86 .100% = 0,57%

\(n_{AgNO_3}=\dfrac{250.4}{100.170}=\dfrac{1}{17}\left(mol\right)\)
Sau phản ứng, lượng AgNO3 giảm đi là khối lượng AgNO3 đã tác dụng \(\Rightarrow n_{AgNO_3}\left(pứ\right)=17\%.\dfrac{1}{17}=0,01\left(mol\right)\) \(Cu\left(0,005\right)+2AgNO_3\left(0,01\right)\rightarrow Cu\left(NO_3\right)_2+2Ag\left(0,01\right)\) Theo PTHH: \(\left\{{}\begin{matrix}n_{Cu\left(tan-ra\right)}=0,005\left(mol\right)\\n_{Ag\left(tao-thanh\right)}=0,01\left(mol\right)\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}m_{Cu\left(tan-ra\right)}=0,32\left(g\right)\\m_{Ag\left(tao-thanh\right)}=1,08\left(g\right)\end{matrix}\right.\) => Sau phản ứng khối lượng thanh kim loại tăng: \(=1,08-0,32=0,76\left(g\right)\) \(\Rightarrow m_{c.ran-sau-pứ}=20+0,76=10,76\left(g\right)\)PTHH: \(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
1 2 2
0.005 0.01 0.01(mol)
\(m_{AgNO3}=\frac{250.4}{100}=10\left(g\right)\)
\(\Rightarrow n_{AgNO3\left(pư\right)}=\frac{10.17}{100.170}=0.01\left(mol\right)\)
Khối lượng vật sau phản ứng:
\(10+\left(108.0,01\right)-\left(64.0,005\right)=10,76\left(g\right)\)



Cu + 2AgNO3 \(\rightarrow\) Cu(NO3)2 + 2Ag
Ta có : nAgNO3 = 1/17 mol => nAgNO3p.ư = 1/17 . 17/100 = 0,01 mol => m = 10 + 0,01(108 - 64/2) = 10,76 gam
số mol của AdNo3 đem phản ứng= (0,17.250.0,04)/170=0,01 mol
số mol của Cu phản ứng bằng 1/2 số mol của Ag+=0.005mol
=> mCu pứ=0,32gam.
số mol của Ag sinh ra bằng 0,01mol
=> mAg sinh ra là 1,08 gam
mCu ban đầu - mCu pứ + mAg sinh ra đk 10,76 gam