Nung hỗn hợp gồm 5,6 gam sắt và 1,6 gam lưu huỳnh trong môi trường không có không khí. Sau phản ứng thu được hỗn hợp chất rắn A. Cho dung dịch HCl 1M phản ứng vừa đủ với A thu đuợc hỗn hợp khí B.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(Fe+S-t^0->FeS\\ n_{Fe}:n_S=\dfrac{11,2}{56}:\dfrac{4,8}{32}=0,2:0,15\Rightarrow Fe:dư\left(0,05mol\right)\\ Fe+2HCl->FeCl_2+H_2\\ FeS+2HCl->FeCl_2+H_2S\\ d_{\dfrac{B}{kk}}=\dfrac{\dfrac{0,05.2+0,15.34}{0,2}}{29}=0,89655\)

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Thành phần của hỗn hợp khí A :
Theo (1) : 0,05 mol Fe tác dụng với 0,05 mol S, sinh ra 0,05 mol FeS.
Theo (2) : 0,05 mol FeS tác dụng với 0,10 mol HCl, sinh ra 0,05 mol H 2 S
Theo (3) : 0,05 moi Fe dư tác dụng với 0,10 mol HCl, sinh ra 0,05 mol HCl
Kết luận : Hỗn hợp khí A có thành phần phần trăm theo thể tích :
50% khí H 2 S và 50% khí H 2

\(m_{Fe}=\frac{5,6}{56}=0,1\left(mol\right)\); \(m_S=\frac{1,6}{32}=0,05\left(mol\right)\)
PTHH: Fe + S --> FeS
0,1 0,05
Xét tỉ lệ: \(\frac{0,1}{1}>\frac{0,05}{1}\) => Fe dư, S hết
PTHH: Fe + S --> FeS
0,05 - 0,05 - 0,05 (mol)
\(=>\left\{{}\begin{matrix}n_{FeS}=0,05\left(mol\right)\\n_{Fe\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\end{matrix}\right.\)
PTHH: FeS + 2HCl --> FeCl2 + H2S
0,05 -> 0,1 (mol)
Fe +2HCl --> FeCl2 + H2
0,05 -> 0,1 (mol)
=> \(n_{HCl}=0,1+0,1=0,2\left(mol\right)\)
=> \(V_{HCl}=0,2.1=0,2\left(l\right)\)
MIK NGHĨ ZẬY !!!

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Nồng độ mol của dung dịch HCL :
Tổng số mol HCL tham gia các phản ứng (2), (3), (4) :
0,1 + 0,1 + 0,0125 = 0,2125 (mol)
Nồng độ mol của dung dịch HCl : 0,2125/0,5 = 0,425 (mol/l)

nFe = 0,1 mol; nS = 0,05 mol
a) Phương trình phản ứng:
Fe + S → FeS (1)
nFe dư = 0,1 – 0,05 = 0,05 nên hỗn hợp chất rắn A có Fe và FeS.
Fe + 2HCl → FeCl2 + H2↑ (2)
FeS + 2HCl → FeCl2 + H2S↑ (3)
b) Dựa vào phương trình phản ứng (2) và (3), ta có:
nHCl= 0,1 + 0,1 = 0,2 mol
VHCl = 0,2 /1 = 0,2 lít.

nFe = \(\frac{5,6}{56}\) = 0,1 mol; ns = \(\frac{1,6}{32}\) = 0,05 mol.
a) Phương trình hoá học: Fe + S \(\underrightarrow{t^o}\) FeS.
Lúc ban đầu: 0,1 0,05 0 (mol)
Lúc phản ứng: 0,05 0,05 0,05
Sau phản ứng: 0,05 0 0,05
Chất rắn A gồm FeS và Fe dư + HCl?
FeS + 2HCl → FeCl2 + H2S
Phản ứng: 0,05 0,1 0,05 0,05 (mol)
Fe + 2HCl → FeCl2 + H2
Phản ứng: 0,05 0,1 0,05 0,05 (mol).
Số mol HCl tham giá phản ứng = 0,1 + 0,1 = 0,2 mol.
Thể tích dung dịch HCl 1M dùng là: Vdd = \(\frac{n}{C_M}\) = \(\frac{0,2}{1}\) = 0,2 lít.

`a)`
`n_{Fe}=0,1(mol);n_S=0,05(mol)`
`S+Fe` $\xrightarrow{t^o}$ `FeS`
`0,05->0,05->0,05(mol)`
`0,1>0,05->Fe` dư.
`->X` gồm `Fe:0,1-0,05=0,05(mol);FeS:0,05(mol)`
`Fe+2HCl->FeCl_2+H_2`
`FeS+2HCl->FeCl_2+H_2S`
Theo PT: `n_{H_2}=n_{Fe}=0,05(mol);n_{H_2S}=n_{FeS}=0,05(mol)`
`->\%V_{H_2}=\%V_{H_2S}={0,05}/{0,05+0,05}.100\%=50\%`
`b)`
`n_{NaOH}=0,125.0,1=0,0125(mol)`
`NaOH+HCl->NaCl+H_2O`
Theo PT: `\sum n_{HCl}=n_{NaOH}+2n_{H_2}+2n_{H_2S}=0,2125(mol)`
`->C_{M\ HCl}={0,2125}/{0,5}=0,425M`





nFe =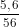 = 0,1 mol; ns =
= 0,1 mol; ns = 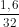 = 0,05 mol.
= 0,05 mol.
a) Phương trình hoá học: Fe + S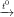 FeS.
FeS.
Lúc ban đầu: 0,1 0,05 0 (mol)
Lúc phản ứng: 0,05 0,05 0,05
Sau phản ứng: 0,05 0 0,05
Chất rắn A gồm FeS và Fe dư + HCl?
FeS + 2HCl → FeCl2 + H2S
Phản ứng: 0,05 0,1 0,05 0,05 (mol)
Fe + 2HCl → FeCl2 + H2
Phản ứng: 0,05 0,1 0,05 0,05 (mol).
Số mol HCl tham giá phản ứng = 0,1 + 0,1 = 0,2 mol.
Thể tích dung dịch HCl 1M dùng là: Vdd =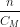 =
= 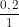 = 0,2 lít.
= 0,2 lít.