Muốn cho cân bằng của phản ứng tổng hợp amoniac chuyển dịch sang phải, cần phải đồng thời
A. tăng áp suất và tăng nhiệt độ.
B. giảm áp suất và giảm nhiệt độ.
C. tăng áp suất và giảm nhiệt độ.
D. giảm áp suất và tăng nhiệt độ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Đáp án C.
- Phản ứng điều chế NH3:
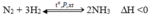
- Sau phản ứng số mol khí giảm nên theo nguyên lí chuyển dịch cân bằng khi tăng áp suất cân bằng chuyển dịch theo chiều giảm áp suất (chiều thuận).
- Phản ứng này toả nhiệt nên khi giảm nhiệt độ cân bằng chuyển dịch theo chiều tăng nhiệt độ (chiều thuận)

Đáp án C
- Dùng xúc tác có tác dụng tăng tốc độ phản ứng
- Phản ứng có ΔH < 0 ⇒ Phản ứng thuận tỏa nhiệt. Nên để tăng hiệu suất cần giảm nhiệt độ phản ứng, tuy nhiên nếu ở nhiệt độ quá thấp, các phân tử khí không có đủ năng lượng để xảy ra va chạm và tạo ra sản phẩm nên nhiệt độ thích hợp của phản ứng là 400 - 500 độ C
- Phản ứng có tổng hệ số chất khí bên phải nhỏ hơn bên trái nên khi tăng áp suất , cân bằng phản ứng chuyển dịch theo chiều thuận làm tăng hiệu suất vì vậy phản ứng được thực hiện ở áp suất cao (100 - 150 atm)

Đáp án B
Các yếu tố ảnh hưởng đến cân bằng hóa học
+ Nhiệt độ: Đối với phản ứng tỏa nhiệt ( ∆ H < 0 ): Khi tăng nhiệt độ cân bằng chuyển dịch sang chiều nghịch, giảm nhiệt độ cân bằng chuyển dịch sang chiều thuận.
+ Nồng độ: Khi giảm nồng độ của một chất cân bằng sẽ chuyển dịch sang chiều tạo ra chất đó, ngược lại, khi tăng nồng độ của một chất cân bằng sẽ chuyển dịch sang chiều làm giảm nồng độ của chất đó.
+ Áp suất: Khi tăng áp suất cân bằng sẽ chuyển dịch sang chiều giảm số phân tử khí, khi giảm áp suất cân bằng sẽ chuyển dịch sang chiều tăng số phân tử khí.
Vậy các biện pháp (2), (3), (5) sẽ làm cân bằng trên chuyển dịch theo chiều thuận.
Chú ý: Chất xúc tác chỉ có tác dụng làm tăng cả tốc độ phản ứng thuận và tốc độ phản ứng nghịch mà không làm dịch chuyển cân bằng.

Chọn đáp án A.
Dựa vào nguyên lý Le Chatelier ta xét các thay đổi cân bằng:
(1) Khi tăng nhiệt độ → Cân bằng sẽ chuyển dịch theo chiều giảm nhiệt độ tức là chiều thu nhiệt (chiều nghịch) →Khi hạ nhiệt độ thì cân bằng sẽ dịch chuyển theo chiều thuận (ở ý số (3)).
(2) Khi tăng áp suất chung của hệ → Cân bằng sẽ chuyển dịch theo chiều giảm áp suất tức là giảm số phân tử khí của hệ (chiều thuận) →Khi giảm áp suất chung của hệ thì cân bằng sẽ dịch chuyển theo chiều nghịch.
(4) Khi dùng chất xúc tác thì cân bằng không bị chuyển dịch mà chỉ làm cho phản ứng nhanh đạt trạng thái cân bằng tức là chỉ thay đổi tốc độ phản ứng.
(5) Khi giảm nồng độ NH3 → Cân bằng sẽ chuyển dịch theo chiều tăng nồng độ NH3 tức là chiều thuận.

Đáp án C
1. Tăng nhiệt độ, cân bằng chuyển dịch chiều thu nhiệt tức chiều nghịch
2. Tăng áp suất, cân bằng chuyển dịch theo chiều giảm áp suất tức chiều thuận
3. Thêm xúc tác k làm chuyển dịch cân bằng
4. Giảm nhiệt độ -> Chiều thuận
5. Tăng nồng độ SO2 hoặc O2 cân bằng chuyển dịch theo chiều làm giảm SO2 hoặc O2 tức chiều thuận
6. Giảm áp suất -> Chiều nghịch
Vậy có 3 tác động làm cân bằng chuyển dịch theo chiều thuận
Đáp án C

1. Tăng nhiệt độ, cân bằng chuyển dịch chiều thu nhiệt tức chiều nghịch
2. Tăng áp suất, cân bằng chuyển dịch theo chiều giảm áp suất tức chiều thuận
3. Thêm chất xúc tác không làm chuyển dịch cân bằng
4. Giảm nhiệt độ→Chiều thuận
5. Tăng nồng độ SO2 hoặc O2 cân bằng chuyển dịch theo chiều làm giảm SO2 hoặc O2 tức chiều thuận
6. Giảm áp suất →Chiều nghịch
Vậy có 3 tác động làm cân bằng chuyển dịch theo chiều thuận
Đáp án C

Chọn đáp án D
Các yếu tố ảnh hưởng đến cân bằng hóa học
+ Nhiệt độ:
Đối với phản ứng tỏa nhiệt (DH < 0) : Khi tăng nhiệt độ cân bằng chuyển dịch sang chiều nghịch, giảm nhiệt độ cân bằng chuyển dịch sang chiều thuận
Đối với phản ứng thu nhiệt (DH > 0) : Khi tăng nhiệt độ cân bằng chuyển dịch sang chiều thuận, khi giảm nhiệt độ cân bằng chuyển dịch sang chiều nghịch.
+ Nồng độ:
Khi giảm nồng độ của một chất cân bằng sẽ chuyển dịch sang chiều tạo ra chất đó, ngược lại, khi tăng nồng độ của một chất cân bằng sẽ chuyển dịch sang chiều làm giảm nồng độ của chất đó.
+ Áp suất:
Khi tăng áp suất cân bằng sẽ chuyển dịch sang chiều giảm số phân tử khí, khi giảm áp suất cân bằng sẽ chuyển dịch sang chiều tăng số phân tử khí. ( nếu số mol khí 2 bên bằng nhau thì áp suất không ảnh hưởng đến chiều phản ứng)
Chú ý: chất xúc tác chỉ có tác dụng làm tăng tốc độ phản ứng chứ không làm thay đổi chiều phản ứng.
Vậy các biện pháp (2), (3), (5) sẽ làm cân bằng trên chuyển dịch theo chiều thuận.
Đáp án B
Phản ứng thuận của phản ứng tổng hợp amoniac là phản ứng tỏa nhiệt. Vì vậy muốn cân bằng chuyển dịch sang phải thì ta đồng thời phải giảm nhiệt độ và tăng áp suất.