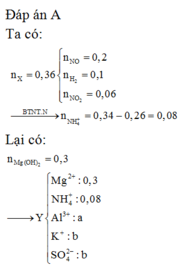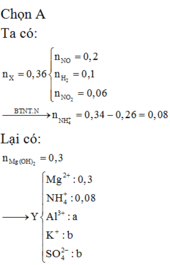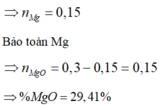40g hỗn hợp AL,AL2O3,MgO đc hòa tan bằng dung dịch NaOH 2M thì thể tích NaOH vừa đủ phản ứng là 300ml,đồng thời thoát ra 6,72dm3 H2(đktc).Tìm % khối lượng hỗn hợp đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{NaOH}=0,3.2=0,6mol\)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
- PTHH: 2Al+2NaOH+2H2O\(\rightarrow\)2NaAlO2+3H2
Al2O3+2NaOH\(\rightarrow\)2NaAlO2+H2O
\(n_{Al}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}.0,3=0,2mol\)
\(m_{Al}=0,2.27=5,4g\)
\(n_{NaOH\left(2\right)}=0,6-n_{NaOH\left(1\right)}=0,6-0,2=0,4mol\)
\(n_{Al_2O_3}=\dfrac{1}{2}n_{NaOH\left(2\right)}=\dfrac{1}{2}.0,4=0,2mol\)
\(m_{Al_2O_3}=0,2.102=20,4g\)
\(m_{MgO}=40-5,4-20,4=14,2g\)
Từ đó: \(\%Al=\dfrac{5,4.100}{40}=13,5\%\)
\(\%Al_2O_3=\dfrac{20,4.100}{40}=51\%\)
%MgO=100%-13,5%-51%=35,5%
2Al + 2NaOH + 2H2O ----->2NaAlO2 + 3H2
Al2O3 + 2NaOH----->2NaAlO2 + H2O
nH2 = 0,3 mol
=> nAl = nNaOH = 0,3.2/3 = 0,2 mol
=> mAl = 0,2 . 27 = 5,4 => %Al = 13,5 %
theo đề bài nNaOH = 0,6 => n_NaOH còn lại = 0,6 - 0,2 = 0,4
=> nAl2O3 = 1/2nNaOH = 0,4/2 = 0,2
=> mAl2O3 = 0,2 . 102 = 20,4 => %Al2O3 = 51 %
=> %MgO = 100 - ( 13,5 + 51 ) = 35,5 %

\(n_{H2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
a) Pt : \(2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2|\)
2 2 2 2 3
0,2 0,2 0,3
\(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O|\)
1 2 2 1
0,1 0,2
b) \(n_{Al}=\dfrac{0,3.2}{3}=0,2\left(mol\right)\)
\(m_{Al}=0,2.27=5,4\left(g\right)\)
\(m_{Al2O3}=15,6-5,4=10,2\left(g\right)\)
c) Có : \(m_{Al2O3}=10,2\left(g\right)\)
\(n_{Al2O3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
\(n_{NaOH\left(tổng\right)}=0,2+0,2=0,4\left(mol\right)\)
\(V_{ddNaOH}=\dfrac{0,4}{1}=0,4\left(l\right)=400\left(ml\right)\)
Chúc bạn học tốt

Lượng khí hidro thoát ra là 0,15 mol.
a) Al2O3 + 2NaOH \(\rightarrow\) 2NaAlO2 + H2O
2Al + 2NaOH + 2H2O \(\rightarrow\) 2NaAlO2 + 3H2.
b) Lượng Al phản ứng bằng 2/3 số mol khí hidro thoát ra và bằng 0,1 mol.
\(\Rightarrow\) %mnhôm=\(\dfrac{27.0,1}{12,9}\).100%\(\approx\)20,93%, %mnhôm oxit\(\approx\)100%-20,93%\(\approx\)79,07%.

Đáp án A
Cho phần 1 tác dụng với 0,4 mol NaOH thấy thoát ra 0,04 mol H2.
Do vậy Al dư 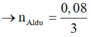
BTNT: ![]()
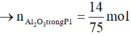
Ta có khối lượng mỗi phần là 39,44 gam.
![]()
Phần 2 tan trong HCl thu được dung dịch Z chứa 98,64 gam muối.
![]()
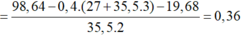
Giải được số mol Cr và Fe trong mỗi phần là 0,12 và 0,24 mol.
Bảo toàn O:
![]()
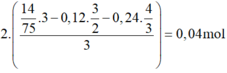

Đáp án A
Cho phần 1 tác dụng với 0,4 mol NaOH thấy thoát ra 0,04 mol H2.
Do vậy Al dư
→ n A l d ư = 0 , 08 3 B T N T : n A l ( P 1 ) = n N a O H = 0 , 4 → n A l 2 O 3 t r o n g P 1 = 14 75 m o l
Ta có khối lượng mỗi phần là 39,44 gam.
→ m C r + m F e = 19 , 68 g a m
Phần 2 tan trong HCl thu được dung dịch Z chứa 98,64 gam muối.
→ n C r + n F e = 98 , 64 - 0 , 4 ( 27 + 35 , 5 . 3 ) - 19 , 68 35 , 5 . 2 = 0 . 36
Giải được số mol Cr và Fe trong mỗi phần là 0,12 và 0,24 mol.
Bảo toàn O:
n A l 2 O 3 t r o n g X = 2 14 75 . 3 - 0 , 12 . 3 2 - 0 , 24 . 4 3 3 = 0 , 04 m o l → % A l 2 O 3 = 5 , 17 %