Nhiệt phân 15,8 gam KMnO4 thu được lượng khó O2,đốt cháy 5,6g Fe trong lượng khó O2 vừa thu được thì sản phẩm sau phản ứng có bị cục nam châm hút không? vì sao
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Phương trình hóa học:
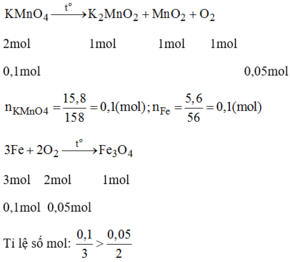
Vậy sắt còn dư nên khi đưa nam châm lại gần sản phẩm sau phản ứng thì nam châm bị hút.

2KMnO4 \(\xrightarrow[]{t^o}\) K2MnO4 + MnO2 + O2(1)
3Fe + 2O2 \(\xrightarrow[]{t^o}\) Fe3O4(2)
nKMnO4 = 15,8 : 158 = 0,1 mol
nFe = 5,6 : 56 = 0,1 mol
Theo pt 1 nO2 = \(\dfrac{1}{2}nKMnO_4=0,05mol\)
Lập tỉ lệ phương trình (2)
nFe : nO2 = \(\dfrac{0,1}{3}:\dfrac{0,05}{2}\)
Do 0,1/3 > 0,05/2 => Fe dư
Vậy sản phẩm thu được có Fe dư => bị nam châm hút

2KMnO4→→K2MnO4+MnO2+O2
\(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}.\dfrac{15,8}{158}=0,05mol\\ n_{Fe}=\dfrac{5,6}{56}=0,1mol\\ 3Fe+2O_2\rightarrow Fe_3O_4\\ \dfrac{0,1}{3}\approx0,33>\dfrac{0,05}{2}=0,25\)
Suy ra Fe dư=0,1-0,05.3:2=0,025 mol. Vậy sản phẩm gồm Fe3O4 và Fe dư nên nam châm vẫn hút.
\(n_{KMnO_4}=\dfrac{15,8}{158}=0,1\left(mol\right)\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: \(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\uparrow\left(1\right)\)
Theo PTHH(1): \(n_{O_2}=\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
PTHH (2): \(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\left(2\right)\)
\(\left\{{}\begin{matrix}\dfrac{n_{Fe}}{3}=\dfrac{0,1}{3}=0,03\\\dfrac{n_{O_2}}{2}=\dfrac{0,05}{2}=0,025\end{matrix}\right.\) \(\Rightarrow\) Fe dư. O2 phản ứng hết
Vậy Fe còn dư nên sản phẩm sau ohanr ứng bị nam châm hút.

2KMnO4\(\rightarrow\)K2MnO4+MnO2+O2
\(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}.\dfrac{15,8}{158}=0,05mol\)
nFe=\(\dfrac{5,6}{56}=0,1mol\)
3Fe+2O2\(\rightarrow\)Fe3O4
\(\dfrac{0,1}{3}\approx0,033>\dfrac{0,05}{2}=0,025\)
Suy ra Fe dư=0,1-0,05.3:2=0,025 mol. Vậy sản phẩm gồm Fe3O4 và Fe dư nên nam châm vẫn hút.

nAl=\(\dfrac{5,4}{27}\)=0,2mol
nO2=\(\dfrac{4,48}{22,4}\)=0,2mol
PTHH:
4Al + 3O2--to->2Al2O3
Tỉ lệ \(\dfrac{0,2}{4}\) <\(\dfrac{0,2}{3}\)->Al hết O2 dưtính theo Al
=>m O2=\(\dfrac{1}{60}\).32=\(\dfrac{8}{15}\)g
2KMnO4-to>K2MnO4+MnO2+O2
0,4--------------------------------------0,2
m KMnO4=0,4.158=63,2g
.

PTHH: \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=\dfrac{m_{KMnO_4}}{M_{KMnO_4}}=\dfrac{15,8}{158}=0,1\left(mol\right)\)
a. Theo PTHH: \(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}0,1=0,05\left(mol\right)\)
\(\Rightarrow V_{O_2}=n_{O_2}.22,4=0,05.22,4=1,12\left(l\right)\)
b. PTHH: \(3Fe+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Ta có: \(\dfrac{1}{n_{O_2}}=\dfrac{1}{0,05}\)
\(\dfrac{1}{n_{Fe}}=\dfrac{1}{0,1}\)
\(\Rightarrow\dfrac{1}{n_{O_2}}>\dfrac{1}{n_{Fe}}\)
Vậy Fe dư
Theo PTHH: \(n_{Fe_3O_4}=\dfrac{0,1.1}{3}=\dfrac{1}{30}\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=\dfrac{1}{30}.232\approx7,73g\)

a.\(n_{KMnO_4}=\dfrac{m}{M}=\dfrac{31,6}{158}=0,2mol\)
\(PTHH:2KMnO_4\underrightarrow{np}K_2MnO_4+MnO_2+O_2\)
2 1 1 1 ( mol )
0,2 0,1
\(V_{O_2}=n.22,4=0,1.22,4=2,24l\)
b.\(n_{Fe}=\dfrac{m}{M}=\dfrac{11,2}{56}=0,2mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
3 2 1 ( mol )
0,2 0,1
0,1 0,1 0,05 ( mol )
\(m_{Fe_3O_4}=n.M=0,05.232=11,6g\)

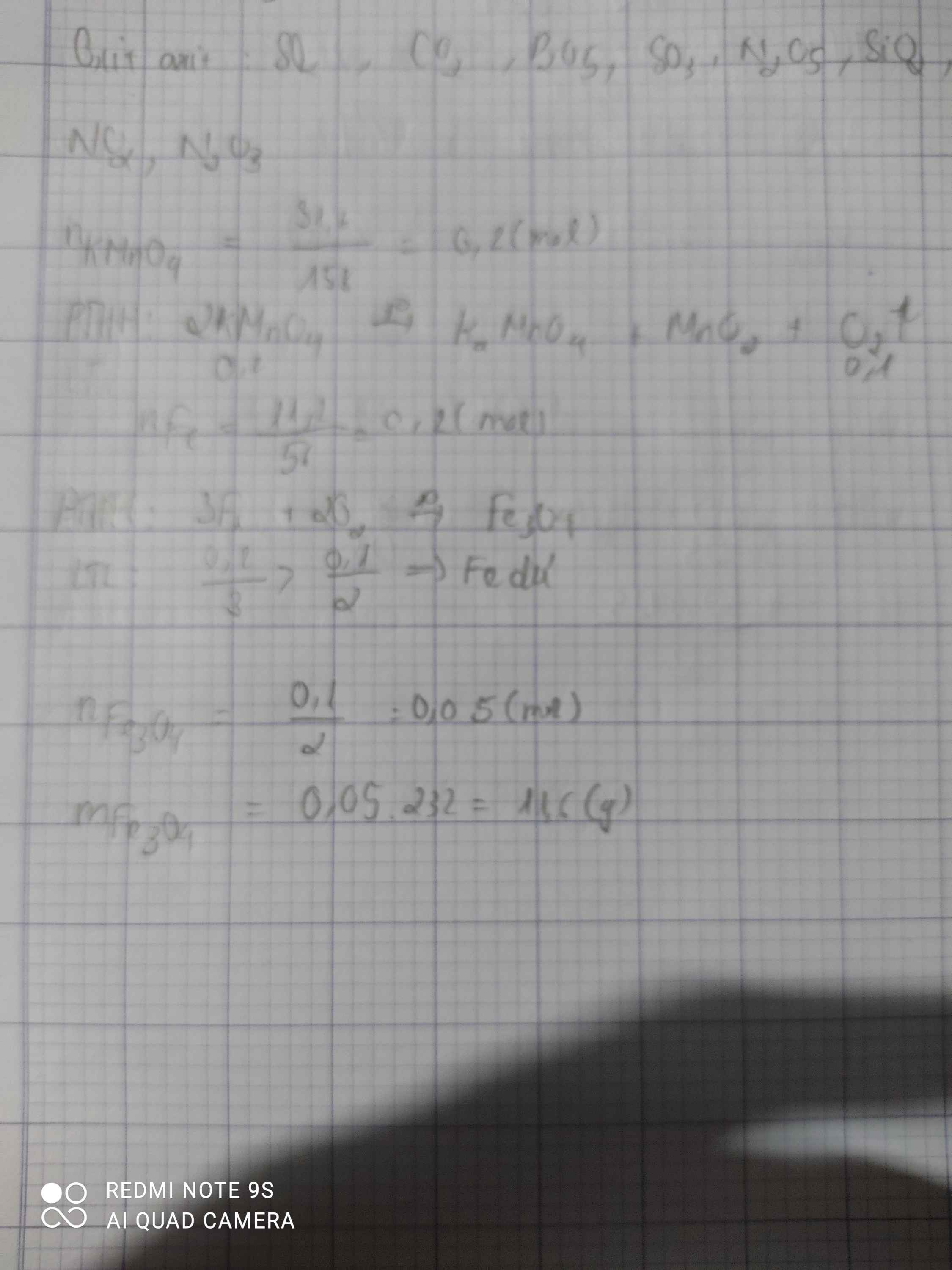

không vì nó kết hợp vs O2 tạo ra oxit
Bài 1:
Bài 2:
a) AgNO3
CTHH AgNO3 mang ý nghĩa:
- Là hợp chất tạo bởi 3 nguyên tố hóa học : Ag , N và O
- Tạo bởi 1 nguyên tử nguyên tố Ag, 1 nguyên tử nguyên tố N và 3 nguyên tử nguyên tố O.
- \(PTK_{AgNO_3}=NTK_{Ag}+NTK_N+3.NTK_O\\ =108+14+3.16=170\left(đ.v.C\right)\)
b) KHSO4
CTHH KHSO4 mang ý nghĩa:
- Là hợp chất cấu tạo từ 4 nguyên tố hóa học: K,H,S và O
- Cấu tạo bởi 1 nguyên tử nguyên tố K, 1 nguyên tử nguyên tố H, 1 nguyên tử nguyên tố A và 4 nguyên tử nguyên tố O.
- \(PTK_{KHSO_4}=NTK_K+NTK_H+NTK_S+4.NTK_O\\ =39+1+32+4.16=136\left(đ.v.C\right)\)
Bài tập 3:
a) Gọi CT ghi hóa trị của S(IV) và O là \(S_x^{IV}O_y^{II}\)(x,y : nguyên, dương)
Theo quy tắc hóa trị, ta có:
\(x.IV=y.II\\ =>\dfrac{x}{y}=\dfrac{II}{IV}=\dfrac{2}{4}=\dfrac{1}{2}\)
=> x=1; y=2
=> CTHH là SO2
b) Gọi CT ghi hóa trị của Al(III) và Cl(I) là \(Al_x^{III}Cl_y^I\) (x,y: nguyên, dương)
Theo quy tắc hóa trị ta có:
\(x.III=y.I\\ =>\dfrac{x}{y}=\dfrac{I}{III}=\dfrac{1}{3}\)
=> x=1; y=3
=> CTHH là AlCl3
Bài 4:
a) Gọi CT gọi hóa trị của hợp chất CuCl2 là \(Cu^aCl_2^b\)(a,b: nguyên, dương)
Theo Quy tắc hóa trị, ta có:
\(1.a=2.b\\ =>\dfrac{a}{b}=\dfrac{2}{1}=\dfrac{II}{I}\)
=> a= II, b=I
=> Trong hợp chất CuCl2 : Cu(II) và Cl(I)
b) Gọi CT kèm hóa trị của hợp chất Fe(NO3)2 là: \(Fe^a\left(NO_3\right)_2^b\) (a,b: nguyên, dương)
Theo quy tắc hóa trị, ta có:
\(1.a=2.b\\ =>\dfrac{a}{b}=\dfrac{2}{1}=\dfrac{II}{I}\\ =>a=II;b=I\)
=> Trong hợp chất Fe(NO3)2 : Fe(II) và nhóm nguyên tử NO3 (I)