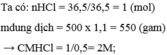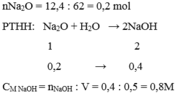BÀI TẬP TÍNH THEO PHƯƠNG TRÌNH HÓA HỌC
Bài 1: Cho 4,6 gam Na vào nước dư, sau phản ứng thu được V lít khí H2 (đktc) và 500ml dung dịch NaOH.
Tìm V
Xác định nồng độ mol của dung dịch naOH sau phản ứng
Bài 2: Hòa tan hoàn toàn 35 gam CaCO3 bằng 300ml dung dịch HCl.
Tìm thể tích khí thoát ra ở đktc.
Xác định nồng độ mol của dung dịch axit HCl đã dùng.
Bài 3: Cho m gam Fe vào 500 ml dung dịch HCl 0,5M sau phản ứng thu được dung dịch X. Để trung hòa dung dịch X cần vừa đủ 50 ml dung dịch KOH 1M. Tính giá trị của m?
Bài 4: Cho 150 ml dung dịch NaOH 0,5M vào 150 ml dung dịch HCl 1M
a. Nếu cho giấy quỳ tím vào dung dịch sau phản ứng thì màu của giấy quỳ tím thay đổi như thế nào? Tại sao?
b. Tính khối lượng muối tạo thành sau phản ứng?
c. Tính nồng độ mol các chất tan trong dung dịch sau phản ứng?
Bài 5: Cho 100 gam dung dịch BaCl2 20,8% vào 150 gam dung dịch Na2SO4 14,2% thu được dung dịch X và m gam kết tủa.
a. Tính khối lượng kết tủa. b. Tính C% của các chất tan trong dung dịch X.
Bài 6: Cho 250 gam dung dịch CuCl2 13,5% tác dụng với 200 gam dung dịch KOH 11,2%
a. Tính khối lượng kết tủa tạo thành.
b. Tính C% của các chất trong dung dịch sau phản ứng?
Bài 7: Cho 200 ml dung dịch H2SO4 1M tác dụng với 6,5 gam kẽm. Tính thể tích khí thu được và khối lượng các chất thu được trong dung dịch sau phản ứng?
Bài 8: Cho 12,4 gam oxit của kim loại hóa trị I vào nước thu được 200 ml dung dịch bazơ có nồng độ 2M. Hãy xác định công thức của oxit trên.
Bài 9: Hòa tan hoàn toàn 8,4 gam một kim loại hóa trị II cần dùng 150 ml dung dịch HCl 2M. Tìm tên kim loại trên.
Bài 10: Hòa tan hoàn toàn 3,2 gam một oxit của một kim loại hóa trị III cần dùng vừa đủ 60 gam dung dịch H2SO4 9,8%. Tìm công thức của oxit trên.