Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

M Al2O3.2SiO2.2H2O =258
%mAl = \(\dfrac{54.100\%}{258}\)=20,93%

2 A l + 3 C u S O 4 → A l 2 S O 4 3 + 3 C u
x…………3/2.x
F e + C u S O 4 → F e S O 4 + C u
y……..y
Al phản ứng hết với C u S O 4 sau đó Fe mới phản ứng với C u S O 4 . Vì sau phản ứng thu được rắn Y gồm 2 kim loại nên Al đã tan hết và Fe có thể đã phản ứng 1 phần hoặc chưa phản ứng. 2 kim loại trong Y là Fe và Cu.
⇒ n C u = n C u S O 4 = 0,2.1 = 0,2 mol
⇒ m F e dư = m Y - m C u = 15,68 - 0,2.64 = 2,88g
Đặt số mol Al ban đầu là x, số mol Fe phản ứng là y, ta có hệ phương trình:
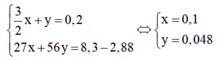
⇒ m A l = 0,1.27 = 2,7g
⇒ % m A l = 2,7/8,3.100 = 32,53%
⇒ Chọn A.

Các quá trình khử :
N{+5} + 3e = N{+2} ; N{+5} + e = N{+4} ; 2N{+5} + 8e = 2N{+1} ; S{+6} + 2e = S{+4}
Ʃne (HNO3 nhận) = 3.nNO + nNO2 + 8.nN2O + 2.nSO2 = 1,4 mol
Các quá trình oxy hóa :
Mg - 2e = Mg{+2} ; Al - 3e = Al{+3}
Áp dụng định luật bảo toàn electron, ta có :
2.nMg + 3.nAl = 1,4
Mặt khác, 24.nMg + 27.nAl = 15
=> nMg = 0,4 mol và nAl = 0,2 mol
=> %mMg = 64% và %mAl = 36%

mFe2O3 = 9.8%*100=9.8g mAl2O3= 10.2% *100=10.2g
=>mCaCO3 = 80g Theo đề, lượng chất rắn thu được sau khi nung chỉ bằng 67% lượng hỗn hợp ban đầu.Như vậy độ giảm khối lượng là do CO2 sinh ra bay đi.
mCO2=100-67=33g => nCO2= 33/44=0.75 mol
PTHH: CaCO3 ---t0---> CaO + CO2
0.75................0.75......0.75
mCaCO3=0.75*100=75g
Như vậy còn 5g CaCO3 còn dư. Do đó chất rắn tạo ra gồm:
CaCO3 dư, Al2O3, Fe2O3 và CaO.
%Al2O3= \(\dfrac{10.2}{67}\cdot100=15.22\%\)
%Fe2O3=\(\dfrac{9.8}{67}\cdot100=14.62\%\)
mCaO = 0.75*56=42g
=> %mCaO = 42%
mFe2O3 = 9.8%*100=9.8g mAl2O3= 10.2% *100=10.2g
=>mCaCO3 = 80g Theo đề, lượng chất rắn thu được sau khi nung chỉ bằng 67% lượng hỗn hợp ban đầu.Như vậy độ giảm khối lượng là do CO2 sinh ra bay đi.
mCO2=100-67=33g => nCO2= 33/44=0.75 mol
PTHH: CaCO3 ---t0---> CaO + CO2
0.75................0.75......0.75
mCaCO3=0.75*100=75g
Như vậy còn 5g CaCO3 còn dư. Do đó chất rắn tạo ra gồm:
CaCO3 dư, Al2O3, Fe2O3 và CaO.
%Al2O3= 10.267⋅100=15.22%10.267⋅100=15.22%
%Fe2O3=9.867⋅100=14.62%9.867⋅100=14.62%
%CaCO3dư = \(\dfrac{5}{67}\cdot100=7.4\%\)
=>%CaO=62.69%

cho anh hỏi nha: khi phản ứng nhiệt nhôm:
Fe2O3 + 2 Al → 2 Fe + Al2O3
cho hỗn hợp pư với NaOH:
Al2O3 + 2NaOH = H2O + 2NaAlO2
nên không có H2 đâu em!!!

a)
Gọi khối lượng của Zn trong đồng thau là : a(g)
Zn+ H2SO4→ ZnSO4+ H2↑
1(g) chất rắn không tan là: Cu
Ta có PT:\(\frac{a}{a+1}.\frac{1}{3}=\frac{a}{a+1+4}\)
⇒ a= 1 (g)
%Cu (đồng thau)=11+111+1 .100%= 50%
b)
Trong B:
%Cu=\(\frac{1}{6}\) .100%= 16,67%
%Zn=\(\frac{1}{6}\).100%= 16,67%
%Al= 100%- 2. 16,67%=66,66%
⇒ Để có tỉ lệ như đề bài yêu cầu thì phải :
Tăng mCu lên: x (g)
Tăng mZn lên : y (g)
mAl giữ nguyên
Ta có :
\(\frac{x+1}{x+y+6}.100\%=20\%\)
\(\frac{y+1}{x+y+6}\text{.100%= 50%}\)
⇒ x=\(\frac{5}{3}\) (g) ; y=\(\frac{17}{3}\) (g)

Đun hỗn hợp với dung dịch NaOH đặc dư
SiO2 + 2NaOH ----> Na2SiO3 + H2O
Al2O3 + 2NaOH ---> 2NaAlO2 + H2O
Lọc tách phần dung dịch rồi dẫn khí CO2 tới dư vào
CO2 + NaOH ___> NaHCO3
CO2 + NaAlO2 + 2H2O--> Al(OH)3 ¯+ NaHCO3
Lọc tách kết tủa rồi nung ở nhiệt độ cao
2Al(OH)3 -----------> Al2O3 + 3H2O

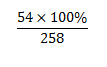 =20,93%
=20,93%
Giải thích các bước giải:
M Al2O3.SiO2.2H2O = 198
%mAl = = 27.2.100:198= 27,27%
48 % nhé bạn