Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

M Al2O3.2SiO2.2H2O =258
%mAl = \(\dfrac{54.100\%}{258}\)=20,93%

Giải thích các bước giải:
M Al2O3.SiO2.2H2O = 198
%mAl = = 27.2.100:198= 27,27%

2 A l + 3 C u S O 4 → A l 2 S O 4 3 + 3 C u
x…………3/2.x
F e + C u S O 4 → F e S O 4 + C u
y……..y
Al phản ứng hết với C u S O 4 sau đó Fe mới phản ứng với C u S O 4 . Vì sau phản ứng thu được rắn Y gồm 2 kim loại nên Al đã tan hết và Fe có thể đã phản ứng 1 phần hoặc chưa phản ứng. 2 kim loại trong Y là Fe và Cu.
⇒ n C u = n C u S O 4 = 0,2.1 = 0,2 mol
⇒ m F e dư = m Y - m C u = 15,68 - 0,2.64 = 2,88g
Đặt số mol Al ban đầu là x, số mol Fe phản ứng là y, ta có hệ phương trình:
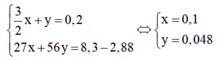
⇒ m A l = 0,1.27 = 2,7g
⇒ % m A l = 2,7/8,3.100 = 32,53%
⇒ Chọn A.

nH2=0.56:22,4=0,025 mol
Fe+H2SO4----->FeSO4+H2
2AL+3H2SO4----->AL2(SO4)3 +3H2
Gọi x,y làn lượt là số mol Fe và AL
ta có hệ pt
mFe=0,01.56=0,56 g
mAl=0,83-0,56=0,27 g
%mFe=(0,56:0,83).100=67,47%
%mAl=100-67,47=32,53%

\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(2A1+2NAOH+2H_2O-2NaA10_2+H_2O\)
\(AI_2O_3=2NaOH+2NaOHA10_2+H_2O\)
\(n_{AI}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}.0,6=0,4\left(mol\right)\)
\(m_{AI}=27.0,4=10,8\left(gam\right);mAI_2O_3=31,2-10,8=20,4\left(gam\right)\)
Biết làm mỗi câu A

Gọi phi kim cần tìm là X
=> hợp chất hiđro của X là: XH 3
Ta có: phần trăm khối lượng của hiđro trong hợp chất là 17,65%
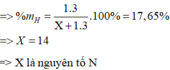
Đáp án: B

\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(\Rightarrow n_{Al}=\dfrac{2}{3}\cdot n_{H_2}=\dfrac{2}{3}\cdot0.15=0.1\left(mol\right)\)
\(m_{Al}=0.1\cdot27=2.7\left(g\right)\)
Cu không phản ứng với HCl
\(m_{Cu}=m_{hh}-m_{Al}=9.1-2.7=6.4\left(g\right)\)
\(\%m_{Al}=\dfrac{2.7}{9.1}\cdot100\%=29.67\%\)
\(\%m_{Cu}=100\%-29.67\%=70.33\%\)
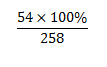 =20,93%
=20,93%
\(\%Al=\dfrac{27.2}{102+60.2+18.2}.100\%\approx20,93\%\)