Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) mdd KOH sau trộn = mKOH(ban đầu) + mH2O = 11,2 + 169,8 = 181(g)
=> C%dd KOH sau trộn = \(\dfrac{m_{ct}}{m_{dd}}.100\%=\dfrac{11,2}{181}.100\%=6,188\%\)
b) Có : nKOH = 11,2/56 = 0,2(mol)
Lại có : Vdd = m : D = 181 : 1,04 =174 (ml) = 0,174(l)
=> CM của dd KOH thu được = n/V = 0,2/0,174 = 1,15(M)
c) Có 2 cách làm : cách 1 áp dụng sơ đồ đường chéo nhưng ở đâu vẽ k được nên làm cách 2 : kiểu truyền thống :)
Gọi mKOH(thêm vào) = a(g)
Có : mKOH / dd A = \(\dfrac{m_{dd}.C\%}{100\%}=\dfrac{150.5\%}{100\%}=7,5\left(g\right)\)
=> Tổng mKOH sau trộn = mKOH / dd A + mKOH thêm vào = 7,5 + a (g)
=> mdd sau trộn = mdd A + mKOH thêm vào = 150 + a (g)
\Có : C%dd KOH sau trộn= \(\dfrac{m_{ct}}{m_{dd}}.100\%=8,5\%\Rightarrow\dfrac{7,5+a}{150+a}=0,085\)
=> 7,5 + a = 12,75 + 0,085a
=>a = 350/61 (g)
Vậy cần thêm 350/61 g KOH

Khi hòa tan Kalihidroxit vào nước ta thu được dung dịch dung dịch Kali hidroxit
\(C\%_{KOH}=\dfrac{11,2.100}{11,2+169,8}=6,19\%\)
\(\Rightarrow C_{M_{KOH}}=\dfrac{10.6,19.1,04}{56}=1,15\left(M\right)\)
Gọi a là khối lượng KOH cần thêm vào
\(m_{KOH}\left(bđ\right)=\dfrac{5.150}{100}=7,5\left(g\right)\)
\(\Rightarrow m_{KOH}\left(sau\right)=\left(7,5+a\right)\left(g\right)\)
\(m_{ddKOH}\left(sau\right)=\left(150+a\right)\left(g\right)\)
Theo đề, sau khi thêm a gam KOH vào A ta thu được dung dịch có nồng độ là 8,5%
\(\Rightarrow8,5=\dfrac{\left(7,5+a\right).100}{150+a}\)
\(\Rightarrow a=5,74\left(g\right)\)
Vậy cần thêm 5,74 gam KOH.

Phương trình hóa học CaCO3 → CaO + CO2.
a) nCaO = 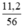 = 0,2 mol.
= 0,2 mol.
Theo PTHH thì nCaCO3 = nCaO = 0,2 (mol)
b) nCaO = 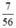 = 0,125 (mol)
= 0,125 (mol)
Theo PTHH thì nCaCO3 = nCaO = 0,125 (mol)
mCaCO3 = M.n = 100.0,125 = 12,5 (g)
c) Theo PTHH thì nCO2 = nCaCO3 = 3,5 (mol)
VCO2 = 22,4.n = 22,4.3,5 = 78,4 (lít)
d) nCO2 = 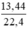 = 0,6 (mol)
= 0,6 (mol)
Theo PTHH nCaO = nCaCO3 = nCO2 = 0,6 (mol)
mCaCO3 = n.M = 0,6.100 = 60 (g)
mCaO = n.M = 0,6.56 = 33,6 (g)

a) \(n_{CaO}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Ta có: \(n_{CaCO_3}=n_{CaO}=0,2\left(mol\right)\)
b) \(n_{CaO}=\dfrac{7}{56}=0,125\left(mol\right)\)
Ta có : \(n_{CaCO_3}=n_{CaO}=0,125\left(mol\right)\)
=> \(m_{CaCO_3}=0,125.100=12,5\left(g\right)\)
c) \(n_{CO_2}=n_{CaCO_3}=3,5\left(mol\right)\)
=> \(V_{CO_2}=3,5.22,4=78,4\left(lít\right)\)
d) \(n_{CO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Ta có: \(n_{CO_2}=n_{CaCO_3}=n_{CaO}=0,6\left(mol\right)\)
=> \(m_{CaCO_3}=0,6.100=60\left(g\right)\)
\(m_{CaO}=0,6.56=33,6\left(g\right)\)

nFe=0,2(mol)
mHCl=29,2(g) => nHCl=0,8(mol)
PTHH: Fe +2 HCl -> FeCl2 + H2
Ta có: 0,2/1 < 0,8/2
=> HCl dư, Fe hết, tính theo nFe
=> nFeCl2=nH2=nFe=0,2(mol) =>mFeCl2= 25,4(g)
=>V(H2,đktc)=0,2.22,4=4,48(l)
nHCl(p.ứ)=2.0,2=0,4(mol) => nHCl(dư)=0,4(mol)
=>mHCl(dư)=0,4.36,5=14,6(g)
mddsau= mddHCl + mFe- mH2=11,2+400-0,2.2=410,8(g)
=>C%ddHCl(dư)=(14,6/410,8).100=3,554%
C%ddFeCl2= (25,4/410,8).100=6,183%

a)
$R + 2HCl \to RCl_2 + H_2$
$2B + 6HCl \to 2BCl_3 + 3H_2$
$n_{H_2} = \dfrac{5,6}{22,4} = 0,25(mol)$
$n_{HCl} = 2n_{H_2} = 0,5(mol)$
Bảo toàn khối lượng : $m_{muối} = m_{kl} + m_{HCl} - m_{H_2}$
$= 9,2 + 0,5.36,5 - 0,25.2 = 26,95(gam)$
b) $V_{dd\ HCl} = \dfrac{0,5}{2} = 0,25(lít)$

C
C