
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án A
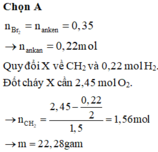
n B r 2 = n a n k e n = 0 , 35 → n a n k a n = 0 , 22 m o l
Quy đổi X về CH2 và 0,22 mol H2.
Đốt cháy X cần 2,45 mol O2.
→ n C H 2 = 2 , 45 - 0 , 22 2 1 , 5 = 1 , 56 m o l → m = 22 , 28 g

Theo bài ra, có nBr2 = 0,35 mol
=> n anken = 0,35 mol => n ankan = 0,22
Đặt hỗn hợp gồm CnH2n với số mol 0,35 mol và CmH2m+2 0,22 mol
CnH2n + 3n/2 O2 -> nCO2 + nH2O
0,35 0,35.3n/2
CmH2m+2 + (3m+1)/2 O2 -> mCO2 + (m+1)H2O
0,22 0,22.(3m+1)/2
=> 0,35.3n/2+0,2(3m+1)/2=2,45 => 0,35n+0,22m=1,56 m = 0,35.14n+0,22.(14m+2)=22,28g
=> Đáp án A

Đáp án A
X gồm C4H4, C4H6, C4H8 và H2.
Đốt cháy hoàn toàn X cần 1,63 mol O2.
Nung X với Ni thu được hỗn hợp Y chỉ gồm các hidrocacbon.
Y gồm C4H4, C4H6, C4H8 và C4H10.
Dựa vào số mol O2 đốt cháy X cũng như Y giải được số mol C và H trong X lần lượt là 1,12 và 2,04
![]()
Khí thoát ra khỏi bình là C4H10 0,07 mol.
Khí phản ứng với dung dịch Br2 là C4H8 và C4H6 dạng CH2=CH-CH=CH2.
Khối lượng bình tăng là khối lượng của 2 hidrocacbon và số mol Br2 phản ứng là 0,11 mol.
Giải được số mol 2 hidrocacbon lần lượt là 0,07 và 0,02 mol.
Hidrocacbon tạo kết tủa với AgNO3/NH3 là C4H4 và C4H6 (but-1-in) có tổng số mol là 0,12 mol.
Mặt khác dựa vào bảo toàn H giải được số mol của 2 hidrocacbon này lần lượt là 0,03 và 0,09 mol.
Kết tủa gồm C4H3Ag 0,03 mol và C4H5Ag 0,09 mol, vậy m=19,26 gam

Đáp án D
15,48(g) C 4 H 4 C 4 H 8 C 4 H 6 H 2 → O 2 ( 1 , 63 ) C O 2 ( a ) H 2 O ( b )
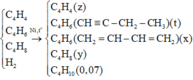
B T K L : 52 z + 54 t = 15 , 48 - 0 , 07 . 58 - 5 B T N T ( C ) : z + t = 1 , 12 - 0 , 07 . 4 - 0 , 02 . 4 - 0 , 07 . 4 4
→ x = 0 , 03 y = 0 , 09 → m = 0 , 03 . 159 + 0 , 09 . 161 = 19 , 26

Định hướng tư duy giải
Ta có:
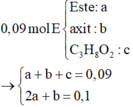
Khi đốt cháy E có:
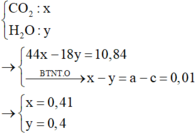
Vậy ta có:
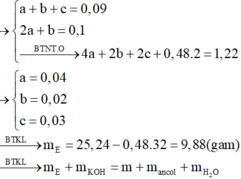
=> 9,88 + 0,1.56 = m + (0,04 +0,03).76 + 0,02.18
=> m = 9,8 (gam).