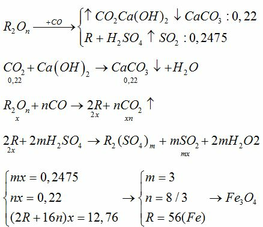Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2 = 0,13 mol; nSO2 = 0,25 mol
Ta có
2H+ + 2e → H2 Cu → Cu2+ + 2e
0,26 ←0,13 0,12 0,24
S+6 + 2e → S+4
0,5 ← 0,25
TH1: M là kim loại có hóa trị không đổi
=> nCu = (0,5 – 0,26) : 2 = 0,12 mol => mCu = 7,68g
=> mM = 3,12g (loại vì khối lượng của M lớn hơn của Cu)
TH2: M là kim loại có hóa trị thay đổi
Do M không có hóa trị I do đó khi phản ứng với HCl thì M thể hiện hóa trị II
M + 2HCl → MCl2 + H2
0,13 ← 0,13
Do M có hóa trị thay đổi => khi phản ứng với H2SO4 đặc nóng thì M thể hiện hóa trị III
2M + 6H2SO4 → M2(SO4)3 + 3SO2 + 6H2O
0,13 → 0,195
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
0,055 ← 0,055
=> mM = 10,8 – 0,055 . 64 = 7,28g
=> MM = 56 => Fe
Ta có số mol của Cu và Fe trong 10,8 g lần lượt là 0,055 và 0,13 mol
=> Trong 5,4g có số mol Cu và Fe lần lượt là 0,0275 và 0,065 mol
nAgNO3 = 0,16mol
Fe + 2AgNO3 → Fe(NO3)2 +2Ag
0,065 0,13 0,065 0,13
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,015 0,03 0,03
=> nCu dư = 0,0275 – 0,015 = 0,0125mol
m = mCu dư + mAg = 0,0125 . 64 + 0,16 . 108 = 18,08g

Qui đổi hh X về Fe, Cu, Mg, Zn và S
Gọi số mol e cho của hh kim loại là x và số mol của S là y
Ta có m kim loại = 10,42 – 32y

m kết tủa lớn nhất = mM(OH)n + mBaSO4
mM(OH)n = m kim loại + mOH- = 10,42 – 32y + 17x
n BaSO4 = nSO42- =x/2 => mBaSO4 =x/2 .233
=> m kết tủa = 10,42 – 32y + 17x + x/2.233 = 43,96 (2)
Từ (1) và (2) => x = 0,28 và y = 0,12
=> m = 10,42 – 32 . 0,12 + . 96 = 20,02

mdd giảm = m↓ - mCO2 → mCO2 = 10 - 3,4 = 6,6 gam → nCO2 = 6,6 : 44 = 0,15 mol.
C6H12O6 enzim−−−−→30−35oC→30-35oCenzim2C2H5OH + 2CO2
Theo phương trình: nC6H12O6 = 0,15 : 2 = 0,075 mol.
Mà H = 90% → nC6H12O6 = 0,075 : 90% = 1/12 mol → m = 180 x 1/12 = 15 gam

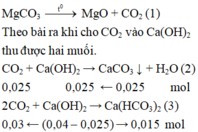
C a H C O 3 2 + 2 N a O H d ư → C a C O 3 ↓ + N a 2 C O 3 + 2 H 2 O ( 4 ) 0 , 015 → 0 , 015 m o l
Đáp án A

- Phần 1 tác dụng với Br2: nBr2 = 16:160 = 0,1 mol
C2H2 + 2Br2 → C2H2Br4
0,05 ← 0,1 (mol)
- Đặt số mol khí mỗi phần như sau:
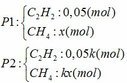
+ Số mol hỗn hợp khí X là: nX = 11,2:22,4 = 0,5 mol
Ta có: n khí P1 + n khí P2 = nX => 0,05 + x + 0,05k + kx = 0,5 <=> (x + 0,05)k = 0,45 - x
=> 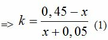
+ Đốt cháy phần 2:
C2H2 + 2,5O2 → t ∘ 2CO2 + H2O
0,05k → 0,1k→ 0,05k (mol)
CH4 + 2O2 → t ∘ CO2 + 2H2O
kx → kx → 2kx (mol)
Sản phẩm cháy gồm
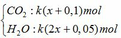
dẫn qua dung dịch Ba(OH)2 dư:
CO2 + Ba(OH)2 → BaCO3↓ + H2O
k(x+0,1) → k(x+0,1) (mol)
Khối lượng dung dịch giảm: m dd giảm = mBaCO3 – mCO2 – mH2O
=> 197k(x+0,1) – 44k(x+0,1) – 18k(2x+0,05) = 69,525
=> 153k(x+0,1) – 18k(2x+0,05) = 69,525
=> k(117x+14,4) = 69,525
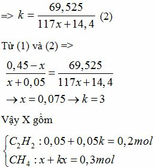
CaC2 + 2H2O → Ca(OH)2 + C2H2
0,2 ← 0,2 (mol)
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
0,1 ← 0,1 (mol)
Giá trị của m là: m = mCaC2 + mAl4C3 = 0,2.64 + 0,1.144 = 27,2 gam
Phần trăm thể tích các khí trong X là:

tác dụng với AgNO3 trong NH3 dư:
C2H2 + 2AgNO3 + 2NH3 → Ag2C2↓ + 2NH4NO3
0,15 → 0,15 (mol)
Khối lượng kết tủa thu được là: mAg2C2 = 0,15.240 = 36 gam

Tính toán theo PTHH :
Fe3O4 + 8 HCl → 2 FeCl3 + FeCl2 + 4 H2O
FeCl2 + ½ Cl2 → FeCl3
FeCl2 + 3 AgNO3 → 2 AgCl + Ag + Fe(NO3)3
FeCl3 + 3 AgNO3 → 3 AgCl + Fe(NO3)3
Bảo toàn khối lượng
m2 – 0,5 m1 = m Cl2 ( lưu ý hỗn hợp chia làm 2 phần nên muối phản ứng ở mỗi phần là 0,5 m1 )
m2 – 0,5 m1 = m Cl2 => m Cl2 = 1,42 => n Cl2 = 0,02 mol
Theo PTHH : n FeCl2 = n Cl2 . 2 = 0,04 mol
Theo PTHH : n FeCl2 . 2 = n FeCl3 = 0,08 mol
Theo PTHH : n AgCl = 2 . nFeCl2 + 3 . n FeCl3 = 0,08 .3 + 0,04 .2 = 0,32 mol
n Ag = n FeCl2 = 0,04 mol
=> m Chất rắn = m Ag + m AgCl = 0,04 . 108 + 0,32 . 143,5 = 50,24 g
phản ứng của Fe2+ + Ag+ → Fe+3 + Ag

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right);n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\)
PTHH: \(Fe+S-^{t^o}\rightarrow FeS\)
Theo đề: 0,2...0,3
Lập tỉ lệ \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\)=> Fe hết. S dư
=> Sau phản ứng hỗn hợp gồm S dư, FeS
=> \(n_{S\left(dư\right)}=0,3-0,2=0,1\left(mol\right)\)
S + H2SO4 → SO2 + H2O
2FeS + 10H2SO4 → Fe2(SO4)3 + 9SO2 + 10H2O
\(\Rightarrow m_{H_2SO_4}=\left(0,1+\dfrac{0,2.10}{2}\right).98=107,8\left(g\right)\)
\(V_{SO_2}=\left(0,1+\dfrac{0,2.9}{2}\right).22,4=22,4\left(l\right)\)
\(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{FeS}=0,1\left(mol\right)\)
3Ba(OH)2 + Fe2(SO4)3 → 2Fe(OH)3↓ + 3BaSO4↓ (*)
Fe(OH)3 ---to→ Fe2O3 + H2O (**)Theo PT (*) : \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe\left(OH\right)_3}=0,05\left(mol\right)\)
Theo PT (**): \(n_{Fe_2O_3}=2n_{Fe\left(OH\right)_3}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe_2O_3}=0,1.160=16\left(g\right)\)