Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Khi hòa tan 1 mol kim loại R thì thu được 0,5 mol R2(SO4)n (khi n = 2 thì thu được 1 mol RSO4, có thể coi là 0,5 mol R2(S04)2)
0,5.(2R + 96n) = 5R Û R = 12n Þ n = 12, R = 24 là Mg.

Xét 1 mol kim loại ứng với R (gam) tham gia phản ứng.
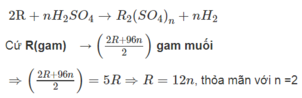
Vậy R=24 (Mg)

2R + nH2SO4 ----> R2(SO4)n + nH2
1 mol ......................... 0,5 mol
Theo bài ra ta có: (2R + 96n). 0,5 = 5.R
=> R = 12n => n = 2 và R = 24.
Vậy R là Mg

Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà n N O 2 = 3 n H 2 n ê n n e n h ư ờ n g ( 1 ) = n N O 2 n e n h ư ờ n g ( 2 ) = 2 n H 2
Nên ne nhường(1) =3/2 ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
n e n h ư ờ n g ( 1 ) n e n h ư ờ n g ( 2 ) = n R . h o a t r i 1 n p . h o a t r i 2 = 3 2
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
m R S O 4 = 62 , 81 % m R ( N O 3 ) 2
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là: n NO2= 3nFe=9
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
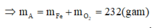
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:
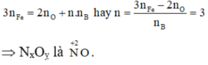
Khi đó:
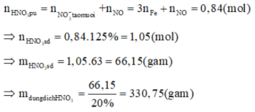

Đáp án C
Áp dụng định luật bảo toàn mol electron, ta có:
Mà nên
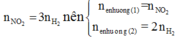
Nên ne nhường(1) = ne nhường(2)
Do đó số mol electron trao đổi ở hai trường hợp là không giống nhau nên R là kim loại có nhiều hóa trị.
Mà kim loại có hóa trị I, II hoặc III.
Kết hợp với
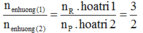
Ta được R có hóa trị II và III (trong đó R thể hiện hóa trị II khi tác dụng với dung dịch H2SO4 loãng và thể hiện hóa trị III khi tác dụng với dung dịch HNO3 đặc nóng).
Chọn 3 mol R đem hòa tan ban đầu. Khi đó ở các lần thí nghiệm ta thu được 3 mol R(NO3)3 và 3 mol RSO4.
Theo giả thiết ta có:
![]()
hay R + 96 = 62,81%(R +186)ÛR = 56ÞR là Fe.
Khi đó, áp dụng định luật bảo toàn moi electron ta có số mol NO2 tạo thành là:
![]()
Khi đó lượng oxi đã sử dụng là 9.22,22% = 2
![]()
A sẽ chứa một hoặc một số oxit của Fe. Để đơn giản cho quá trình tính toán, coi A là hỗn hợp chứa 3 mol Fe và 4 mol O.
Khi đó trong 20,88 gam A (20,88 = 0,09.232) có 0,27 mol Fe và 0,36 mol O.
nB = 0,03.
Gọi n là số mol electron mà x mol nguyên tử N + 5 nhận để thu được 1 mol NxOy
Áp dụng định luật bảo toàn mol electron, ta có:

Þ NxOỵ là .
Khi đó
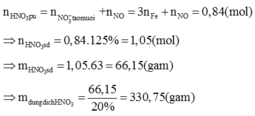

Đáp án B
M + 2HCl → MCl2 + H2
M (M+71)
8,45g 17,68g
=> 17,68.M = 8,45.(M+71)
=> M = 65 (Zn)

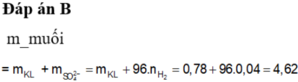

Đáp án D
Khi hòa tan 1 mol kim loại R thì thu được 0,5 mol R2(SO4)n (khi n = 2 thì thu được 1 mol RSO4, có thể coi là 0,5 mol R2(S04)2)
0,5.(2R + 96n) = 5R Û R = 12n Þ n = 12, R = 24 là Mg.