Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo pt: \(\Rightarrow\left\{{}\begin{matrix}3x+y=0,2\\27x+56y=5,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\dfrac{19}{470}\\y=\dfrac{37}{470}\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{\dfrac{19}{470}\cdot27}{5,5}\cdot100\%=19,84\%\)
\(\%m_{Fe}=100\%-19,84\%=80,16\%\)

PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
a) Ta có: \(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)=n_{Mg}\)
\(\Rightarrow\%m_{Mg}=\dfrac{0,5\cdot24}{16}=75\%\) \(\Rightarrow\%m_{MgO}=25\%\)
b) Ta có: \(\left\{{}\begin{matrix}n_{Mg}=0,5\left(mol\right)\\n_{MgO}=\dfrac{16\cdot25\%}{40}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl}=2n_{Mg}+2n_{MgO}=1,2\left(mol\right)\) \(\Rightarrow m_{ddHCl}=\dfrac{1,2\cdot36,5}{20\%}=219\left(g\right)\)
c) Theo các PTHH: \(\left\{{}\begin{matrix}n_{H_2}=0,5\left(mol\right)\\n_{MgCl_2}=0,6\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{H_2}=0,5\cdot2=1\left(g\right)\\m_{MgCl_2}=0,6\cdot95=57\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{hhA}+m_{ddHCl}-m_{H_2}=234\left(g\right)\) \(\Rightarrow C\%_{MgCl_2}=\dfrac{57}{234}\cdot100\%\approx24,36\%\)
Cho mình hỏi ở cái PTHH ấy! sao ta không tính số mol ở dưới??

Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\) ⇒ 27x + 56y = 5,5 (1)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{3}{2}x+y=\dfrac{4,48}{22,4}=0,2\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,1.27}{5,5}.100\%\approx49,09\%\\\%m_{Fe}\approx50,91\%\end{matrix}\right.\)

\(n_{HCl}=\dfrac{500.5,84\%}{36,5}=0,8\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{500.5,88\%}{98}=0,3\left(mol\right)\)
=> \(n_{H\left(trc.pư\right)}=0,8+0,3.2=1,4\left(mol\right)\)
\(n_{H_2}=\dfrac{15,68}{22,4}=0,7\left(mol\right)\)
=> \(n_{H\left(sau.pư\right)}=0,7.2=1,4\left(mol\right)\)
=> Pư vừa đủ
\(m_{muối}=\) mkim loại + mCl + mSO4
= 19,2 + 0,8.35,5 + 0,3.96 = 76,4 (g)
\(n_{H_2}=\dfrac{15,68}{22,4}=0,7\left(mol\right)\rightarrow m_{H_2}=0,7.2=1,4\left(g\right)\\ \left\{{}\begin{matrix}m_{HCl}=5,84\%.500=29,2\left(g\right)\\m_{H_2SO_4}=5,88\%.500=29,4\left(g\right)\end{matrix}\right.\rightarrow m_{axit}=29,2+29,4=58,6\left(g\right)\)
Áp dụng ĐLBTKL, ta có:
mKim loại + maxit = mmuối + mH2
=> mmuối = 19,2 + 58,6 - 1,4 = 76,4 (g)

\(\left\{{}\begin{matrix}m_{Mg}=\dfrac{40.9}{100}=3,6\left(g\right)\\m_{Al}=9-3,6=5,4\left(g\right)\end{matrix}\right.\\ \rightarrow\left\{{}\begin{matrix}n_{Mg}=\dfrac{3,6}{24}=0,15\left(mol\right)\\n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\end{matrix}\right.\)
PTHH:
Mg + 2HCl ---> MgCl2 + H2
0,15 ------------------------> 0,15
2Al + 6HCl ---> 2AlCl3 + 3H2
0,2 ---------------------------> 0,3
\(\rightarrow V_{H_2}=\left(0,15+0,3\right).22,4=10,08\left(l\right)\)
\(n_{H_2O}=\dfrac{6,48}{18}=0,36\left(mol\right)\)
PTHH: FexOy + yH2 --to--> xFe + yH2O
Theo pthh: \(n_{O\left(oxit\right)}=n_{H_2\left(pư\right)}=n_{H_2O}=0,36\left(mol\right)\)
\(\rightarrow m_{oxit}=15,12+16.0,36=20,88\left(g\right)\)
\(n_{Fe}=\dfrac{15,12}{56}=0,27\left(mol\right)\)
CTHH: FexOy
=> x : y = 0,27 : 0,36 = 3 : 4
=> CTHH: Fe3O4 (oxit sắt từ)
mMg = 40%x9 = 3,6(g) =>nMg=3,6:24 = 0,15 (mol)
=> mAl = 9-3,6 = 5,4(g) => nAl = 5,4:27 = 0,2 (mol)
pthh : 2Al+6HCl -> 2AlCl3+3H2
0,2 0,3
Mg+2HCl -> MgCl2 +H2
0,15 0,15
=> nH2 = 0,15 + 0,3 = 0,45 (mol)
=> VH2 = 0,45.22,4 = 10,08 (L)
mH2 = 0,45 . 2 = 0,9 (mol)
áp dụng BLBTKL ta có :
mH2 + moxit sắt = mFe + mH2O
=> moxit sắt = 20,7 (g)

PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a) Ta có: \(\left\{{}\begin{matrix}n_{HCl}=\dfrac{12,7}{36,5}=\dfrac{127}{365}\left(mol\right)\\n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\end{matrix}\right.\)
Ta thấy: \(2n_{H_2}< n_{HCl}\) \(\Rightarrow\) Axit còn dư
b) Theo PTHH: \(n_{HCl\left(p/ứ\right)}=2n_{H_2}=0,3\left(mol\right)\) \(\Rightarrow m_{HCl}=0,3\cdot36,5=10,95\left(g\right)\)
Mặt khác: \(m_{H_2}=0,15\cdot2=0,3\left(g\right)\)
Bảo toàn khối lượng: \(m_{muối}=m_{KL}+m_{HCl\left(p/ứ\right)}-m_{H_2}=18,65\left(g\right)\)
c) PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Khi 8 gam kim loại p/ứ với HCl dư tạo 0,15 mol H2
\(\Rightarrow\) 8 gam kim loại p/ứ với H2SO4 dư cũng tạo 0,15 mol H2
\(\Rightarrow n_{H_2}=n_{H_2SO_4\left(p/ứ\right)}=0,15\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4\left(p/ứ\right)}=0,15\cdot98=14,7\left(g\right)\)

\(m_{HCl}=\dfrac{124,1\cdot25}{100}=31,025g\)
\(\Rightarrow n_{HCl}=0,85mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
x 3x
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
y 2y
\(\Rightarrow\left\{{}\begin{matrix}27x+65y=17,05\\3x+2y=0,85\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,15\\y=0,2\end{matrix}\right.\)
\(\%m_{Zn}=\dfrac{0,2\cdot65}{17,05}\cdot100\%=75,25\%\)

2. Ta có : \(n_{Na}>n_{Al}\) nên Al sẽ tan hết
Số mol H2 thu được: \(\dfrac{5 + 4.3}{2}=8,5 \)(mol)
Như vậy, khi cho Fe vào H2SO4 sẽ thu được 2,125 mol khí
\(\Rightarrow n_{Fe}=2,125 \) (mol)
=>\(\%m_{Na}=\dfrac{5.23}{5.23+4.27+56.2,125}.100=33,63\%\)
=> Chọn B
\(\begin{cases} nMg=a (mol)\\ nAl=b (mol) \end{cases} \)=> 24a +27b=12,6 (1)
n(H2)= 0,6mol
Mg+H2SO4 ---> MgSO4 +H2
a. a a. (Mol)
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
b. 1,5b 0,5b 1,5b. (Mol)
=> a+1,5b=0,6 (2)
Từ (1) và (2) => \(\begin{cases} a=0,3\\ b=0,2 \end{cases}\)
n(H2SO4) =n(H2) =0,6mol
m(H2SO4)= 0,6*98=58,8(g)
m(dd H2SO4)=58,8*100/20 =294(g)
mdd= 12,6+294-0,6*2=305,4(g)
C%(Al2(SO4)3)= \(\dfrac{0,5*0,2*342*100%}{305,4}\)=11,198%
Câu 1 Chọn B

Gọi nFe = a (mol); nAl = b (mol)
=> 56a + 27b = 11 (1)
nH2 = 8,96/22,4 = 0,4 (mol)
PTHH:
Fe + 2HCl -> FeCl2 + H2
a ---> 2a ---> a ---> a
2Al + 6HCl -> 2AlCl3 + 3H2
b ---> 1,5b ---> b ---> b
=> a + 1,5b = 0,4 (2)
Từ (1)(2) => a = 0,1 (mol); b = 0,15 (mol)
mFe = 0,1 . 56 = 5,6 (g)
mAl = 0,2 . 27 = 5,4 (g)
THAM KHẢO :
Fe + 2HCl -> FeCl2 + H2 (1)
a) 2Al + 6HCl -> 2AlCl3 + 3H2 (2)
Gọi khối lượng Fe là x(g) (0<x<11) => nFe = x/56 (mol)
Thì mAl là 11-x(g) => nAl = (11-x)/27 (mol)
nH2 = 8,96/22,4 = 0,4 (mol)
Theo PT (1) ta có: nH2 = nFe = x/56 (mol)
Theo PT (2) ta có: nH2 = 3/2 nAl = 3/2 . (11-x)/27 = (11-x)/18 (mol)
Theo đề bài, nH2 thu được là 0,4(mol) nên ta có:
x/56 + (11-x)/18 = 0,4
<=> 18x +56(11-x) = 403,2
<=> x = 5,6 (g)
Do đó: mFe = 5,6(g) => nFe = 5,6/56 = 0,1 (mol)
mAl = 11-5,6 = 5,4(g) => nAl = 5,4/27 = 0,2 (mol)

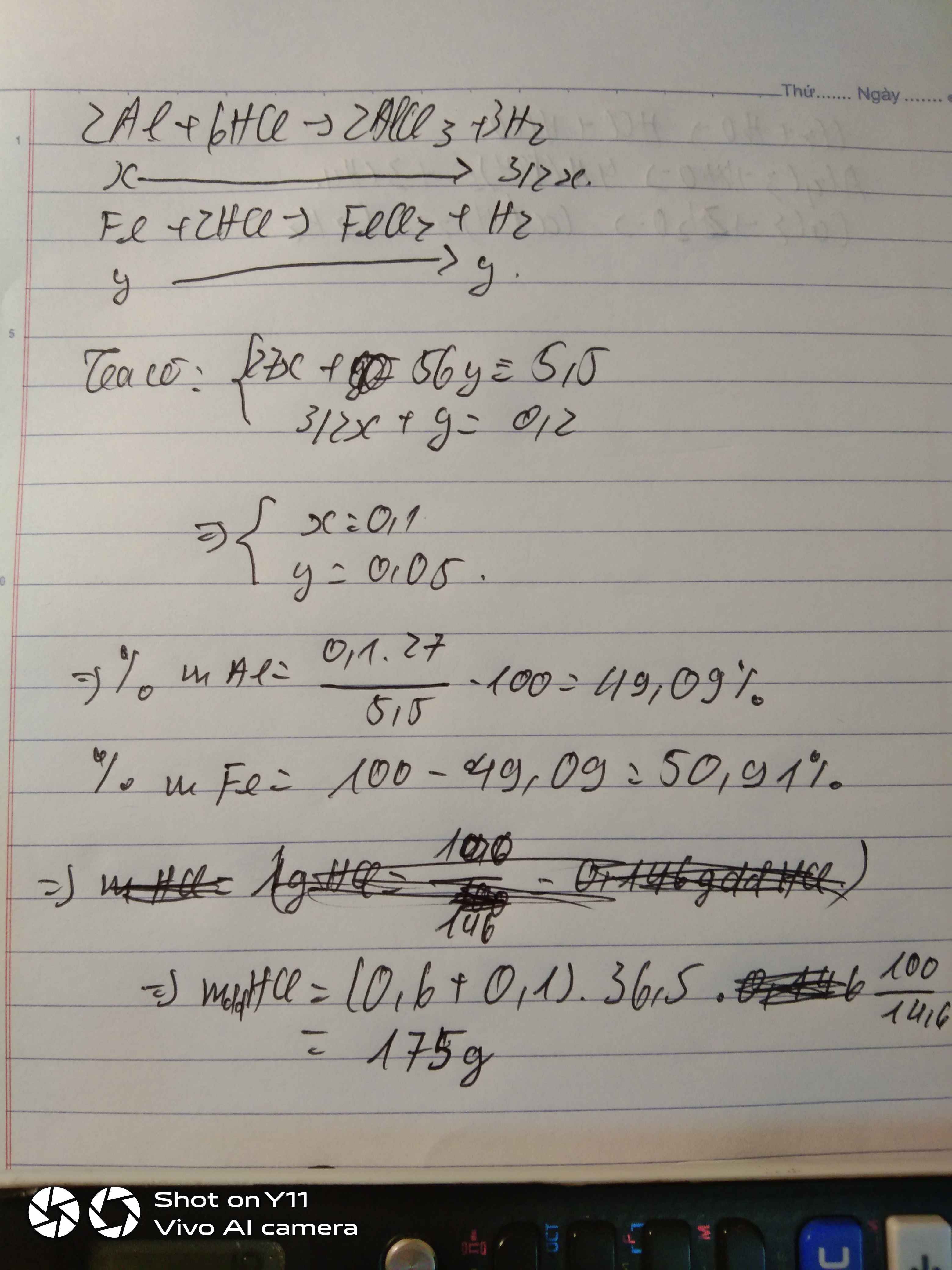

pthh:
Al2Mg3 + 6HCl → 2AlCl3 + 3MgH2
Ta có: n(Al2Mg3) = 0,05 mol → n(H2) = 3. 0,05 : 2 = 0,07 mol
∆m(dd) = m(Al) – m(H2) = 2,7 – 0,15. 2 = 2,4 (g) > 0 → Khối lượng dung dịch sau p.ư tăng 2,4 g
Gọi nAl = a (mol); nMg = b (mol)
27a + 24b = 6,12 (g) (1)
nH2 = 6,72/22,4 = 0,3 (mol)
mH2 = 0,3 . 2 = 0,6 (g)
PTHH:
2Al + 6HCl -> 2AlCl3 + 3H2
Mol: a ---> 3a ---> a ---> 1,5a
Mg + 2HCl -> MgCl2 + H2
Mol: b ---> 2b ---> b ---> b
=> 1,5a + b = 0,3 (mol) (2)
Từ (1), (2) => a = b = 0,12 (mol)
m bình đựng HCl (ban đầu) = (3 . 0,12 + 2 . 0,12) . 36,5 = 21,9 (g)
m bình đựng HCl (sau p/ư) = 21,9 + 6,12 - 0,6 = 27,42 (g)
m tăng = 27,42 - 21,9 = 5,52 (g)