Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chất khí dễ cháy hoàn toàn hơn các chất lỏng và chất rắn vì dễ tạo ra được hỗn hợp với không khí, khi đó diện tích tiếp xúc của nhiên liệu với không khí lớn hơn nhiều so với chất lỏng và chất rắn.
Đáp án: C

Đối với chất khí: Do các phân tử chất khí ở xa nhau nên các phân tử nhiên liệu khí và oxi dễ dàng trộn lẫn vào nhau, diện tích tiếp xúc với oxi lớn. Đối với chất lỏng thì bề mặt nhiên liệu lỏng sẽ nóng lên trước, sau đó thì phần chất lỏng bên dưới sẽ nóng lên theo, và diện tích tiếp xúc với không khí lớn hơn so với chất rắn => Dễ cháy hoàn toàn
Vì các phân tử khí ở xa nhau => bề mặt tiếp xúc với oxi lớn. Mà oxi là chất duy trì sự cháy => chất khí dễ cháy hoàn toàn so với các chất khác (chất lỏng và chất rắn).

A có thể là : HCl
B có thể là : SiO2
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(Fe_3O_4+8HCl\rightarrow2FeCl_3+FeCl_2+4H_2O\)
A: NaOH, B: Fe3O4
\(2NaOH+Al_2O_3->2NaAlO_2+H_2O\)
\(2NaOH+SiO_2->Na_2SiO_3+H_2O\)

Chất khí dễ cháy hoàn toàn hơn các chất lỏng và các chất rắn vì dễ tạo ra được hỗn ợp với không khí , khi đó diện tích tiếp xúc của nhiên liệu với không khí nhiều hơn so với chất lỏng và chát rắn.

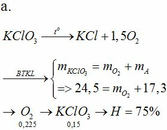
b.
4P + 5O2 → 2P2O5
0,16→ 0,2
Dư: 0,025
Sau pứ m(bình 1) = mP2O5 = 11,36 (g)
O2 + 2C → 2CO
0,025→ 0,05 0,05
Dư: 0,25
Sau pứ m(bình 2) = mCdư = 3 (g)

Đặt \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
Theo đề: \(m_{hh}=36\left(g\right)\)
\(\Rightarrow m_{Mg}+m_{Fe}=36\\ \Rightarrow24x+56y=36\left(1\right)\)
\(PTHH:2Mg+O_2\underrightarrow{t^o}2MgO\\ \left(mol\right)....x\rightarrow...0,5x.....x\\ PTHH:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\ \left(mol\right)....y\rightarrow...\dfrac{2}{3}y....\dfrac{1}{3}y\)
Theo đề: \(n_{O_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(\Rightarrow0,5x+\dfrac{2}{3}y=0,6\left(2\right)\)
\(\xrightarrow[\left(2\right)]{\left(1\right)}\left\{{}\begin{matrix}24x+56y=36\\0,5x+\dfrac{2}{3}y=0,6\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}x=0,8\\y=0,3\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,8.24=19,2\left(g\right)\\m_{Fe}=0,3.56=16,8\left(g\right)\end{matrix}\right.\\ m_r=m_{MgO}+m_{Fe_3O_4}=0,8.40+\dfrac{1}{3}.0,3.232=55,2\left(g\right)\)
PTHH: C+O2→CO20,3mol:0,3mol→0,3molC+O2→CO20,3mol:0,3mol→0,3mol
S+O2→SO20,2mol:0,2mol→0,2molS+O2→SO20,2mol:0,2mol→0,2mol
mC=36%10100%=3,6(g)⇔nC=3,612=0,3(mol)mC=36%10100%=3,6(g)⇔nC=3,612=0,3(mol)
mS=10−3,6=6,4(g)⇔nS=6,432=0,2(mol)mS=10−3,6=6,4(g)⇔nS=6,432=0,2(mol)
VO2=(0,3+0,2)22,4=11,2(l)VO2=(0,3+0,2)22,4=11,2(l)
mhh=mCO2+mSO2=0,3.44+0,2.64=26(g)

Đặt \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
Theo đề: \(m_{hh}=39\left(g\right)\)
\(\Rightarrow m_{Al}+m_{Fe}=39\\ \Rightarrow27x+56y=39\left(1\right)\)
\(PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\\ \left(mol\right)....x\rightarrow..0.75x....0,5x\\ PTHH:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\ \left(mol\right)....y\rightarrow..\dfrac{2}{3}y.....\dfrac{1}{3}y\)
Theo đề: \(n_{O_2}=\dfrac{V}{22,4}=\dfrac{12,32}{22,4}=0,55\left(mol\right)\)
\(\Rightarrow0,75x+\dfrac{2}{3}y=0,55\left(2\right)\)
\(\xrightarrow[\left(1\right)]{\left(2\right)}\left\{{}\begin{matrix}27x+56y=39\\0,75x+\dfrac{2}{3}y=0,55\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,6\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}m_{Al}=0,2.27=5,4\left(g\right)\\m_{Fe}=0,6.56=33,6\left(g\right)\end{matrix}\right.\\ m_r=m_{Al_2O_3}+m_{Fe_3O_4}=0,5.0,2.102+\dfrac{1}{3}.0,6.232=56,6\left(g\right)\)


Chất khí dễ cháy hoàn toàn hơn các chất lỏng và các chất rắn vì dễ tạo ra được hỗn hợp với không khí, khi đó diện tích tiếp xúc của nhiên liệu với không khí nhiều hơn so với chất lỏng và chất rắn.
Chất khi dễ cháy hoàn toàn do diện tích bề mặt tiếp xúc của chất khí với oxi trong không khí lớn hơn chất lỏng và chất rắn nên có hiệu suất phản ứng cao hơn.