Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\)
Do khi hòa tan A vào HCl thu được hỗn hợp khí
=> Trong A chứa H2, H2S
=> Al dư, S hết
PTHH: 2Al + 3S --to--> Al2S3
0,2<--0,3------>0,1
2Al + 6HCl --> 2AlCl3 + 3H2
0,1----------------------->0,15
Al2S3 + 6HCl --> 2AlCl3 + 3H2S
0,1------------------------>0,3
=> \(\overline{M}_X=\dfrac{0,15.2+0,3.34}{0,15+0,3}=\dfrac{70}{3}\left(g/mol\right)\)
=> \(d_{X/H_2}=\dfrac{\dfrac{70}{3}}{2}=\dfrac{35}{3}\)

Đặt nZn = x mol; nFe = y mol.
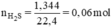
Ta có hệ phương trình: 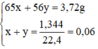
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Bài 1.
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(n_S=\dfrac{4,8}{32}=0,15mol\)
\(Fe+S\rightarrow\left(t^o\right)FeS\)
0,2 < 0,15 ( mol )
0,15 0,15 0,15 ( mol )
X gồm FeS và Fe(dư)
\(\left\{{}\begin{matrix}m_{FeS}=0,15.88=13,2g\\m_{Fe\left(dư\right)}=\left(0,2-0,15\right).56=2,8g\end{matrix}\right.\)
\(Fe+HCl\rightarrow FeCl_2+H_2\)
0,05 0,05 ( mol )
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
0,15 0,15 ( mol )
\(V_{hh}=V_{H_2}+V_{H_2S}=\left(0,05+0,15\right).22,4=4,48l\)
Bài 2.
\(n_{SO_2}=\dfrac{2,688}{22,4}=0,12mol\)
\(M+nH_2SO_4\left(đ\right)\rightarrow\left(t^o\right)\dfrac{1}{2}M_2\left(SO_4\right)_n+\dfrac{n}{2}SO_2+nH_2O\)
\(\dfrac{0,24}{n}\) \(0,12\) ( mol )
\(\rightarrow\dfrac{0,24M_M}{n}=7,68\)
\(\Leftrightarrow M_M=32n\)
Xét:
n=1 --> Lưu huỳnh ( loại )
n=2 --> Cu ( nhận )
n=3 --> Loại
Vậy kim loại đó là Cu
\(n_{NaOH}=2.0,5=1mol\)
\(T=\dfrac{n_{NaOH}}{n_{SO_2}}=\dfrac{1}{0,12}=8,3\) --> Tạo ra muối Na2SO3
\(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
0,12 0,12 ( mol )
\(C_{M_{Na_2SO_3}}=\dfrac{0,12}{0,5}=0,24M\)

- Chất rắn không tan trong HCL dư là S => m S dư = 3,8g
Kết tủa đen là CuS => n CuS = 0,1 = n H 2 S = nS phản ứng
m S phản ứng = 3,2g
0,2 mol Z gồm 0,1 mol H 2 S và 0,1 mol H 2
m ban đầu = 3,8 + 3,2 = 7g
Ta lại có
n Fe p / u = n S p / u = 0,1 mol
n Fe dư = n H 2 = 0,1 mol
n Fe ban đầu → m Fe ban đầu = 0,2 .56 = 1,12 g
Vậy m = 11,2 + 0,7 = 18,2 (gam)

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
Phương trình hóa học của phản ứng:
Zn + S → ZnS
Fe + S → FeS
ZnS + H2SO4 → ZnSO4 + H2S
FeS + H2SO4 → H2S + FeSO4

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
PTHH: Fe + S --to--> FeS (1)
LTL: \(0,2>0,15\rightarrow\) Fe dư
Theo pthh (1):
\(n_{Fe\left(pư\right)}=n_{FeS}=n_S=0,15\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}m_{Fe\left(dư\right)}=\left(0,2-0,15\right).56=2,8\left(g\right)\\m_{FeS}=0,15.88=13,2\left(g\right)\end{matrix}\right.\)
PTHH:
FeS + 2HCl ---> FeCl2 + H2S
0,15 0,15
Fe + 2HCl ---> FeCl2 + H2
0,05 0,05
\(\rightarrow M_Z=\dfrac{0,15.34+0,05.2}{0,15+0,05}=26\left(\dfrac{g}{mol}\right)\)
=> dZ/H2 = \(\dfrac{26}{2}=13\)


\(H_2S + Pb(NO_3)_2 \to PbS + 2HNO_3\\ n_{H_2S} = n_{PbS} = \dfrac{23,9}{239} = 0,1(mol)\\ \Rightarrow n_{H_2} = \dfrac{4,48}{22,4} - 0,1 = 0,1(mol)\\ Fe + 2HCl \to FeCl_2 + H_2\\ FeS + 2HCl \to FeCl_2 + H_2S\\ Fe + S \xrightarrow{t^o} FeS\\ n_{Fe} = n_{Fe} + n_{FeS} = n_{H_2} + n_{H_2S} = 0,2(mol)\\ n_S = n_{FeS} = n_{H_2S} = 0,1(mol)\\ \Rightarrow m = 0,2.56 + 0,1.32 = 14,4(gam) \)