Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Khối lượng chất rắn tăng bằng khối lượng của Cl2 => Số mol Cl2
=> Số mol Al tham gia phản ứng => Khối lượng Al tham gia phản ứng:
nCl2 = 4,26/71 = 0,06 mol
=> nAl = 0,06x2/3 = 0, 04 mol
=> mAl = 0,04 x 27 = 1,08 gam.

Đáp án B
2Al + 3 Cl 2 → 2 AlCl 3
Dễ thấy m chất rắn tăng = m Cl 2 = 7,1g
=> nCl2 = 0,1 mol
nAl = 2/3 n Cl 2 = 1/15 mol
=> mAl = nAl. MAl = 1/15. 27 = 1,8g

\(2Al+3Cl_2\rightarrow\left(t^o\right)2AlCl_3\\ m_{tăng}=m_{Cl_2}\Rightarrow n_{Cl_2}=\dfrac{14,2}{71}=0,2\left(mol\right)\\ \Rightarrow n_{Al}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ Vậy:m_{Al}=\dfrac{2}{15}.27=3,6\left(g\right)\)

m tăng là m Cl2 phản ứng:
nCl2 = \(\dfrac{4,26}{72}\)= 0,06 (mol)
PTHH: 2Al + 3Cl \(\rightarrow\) 2AlCl3
0,04mol \(\leftarrow\) 0,06mol
\(\rightarrow\) mAl = 0,04 x 27 = 1,08 (g)

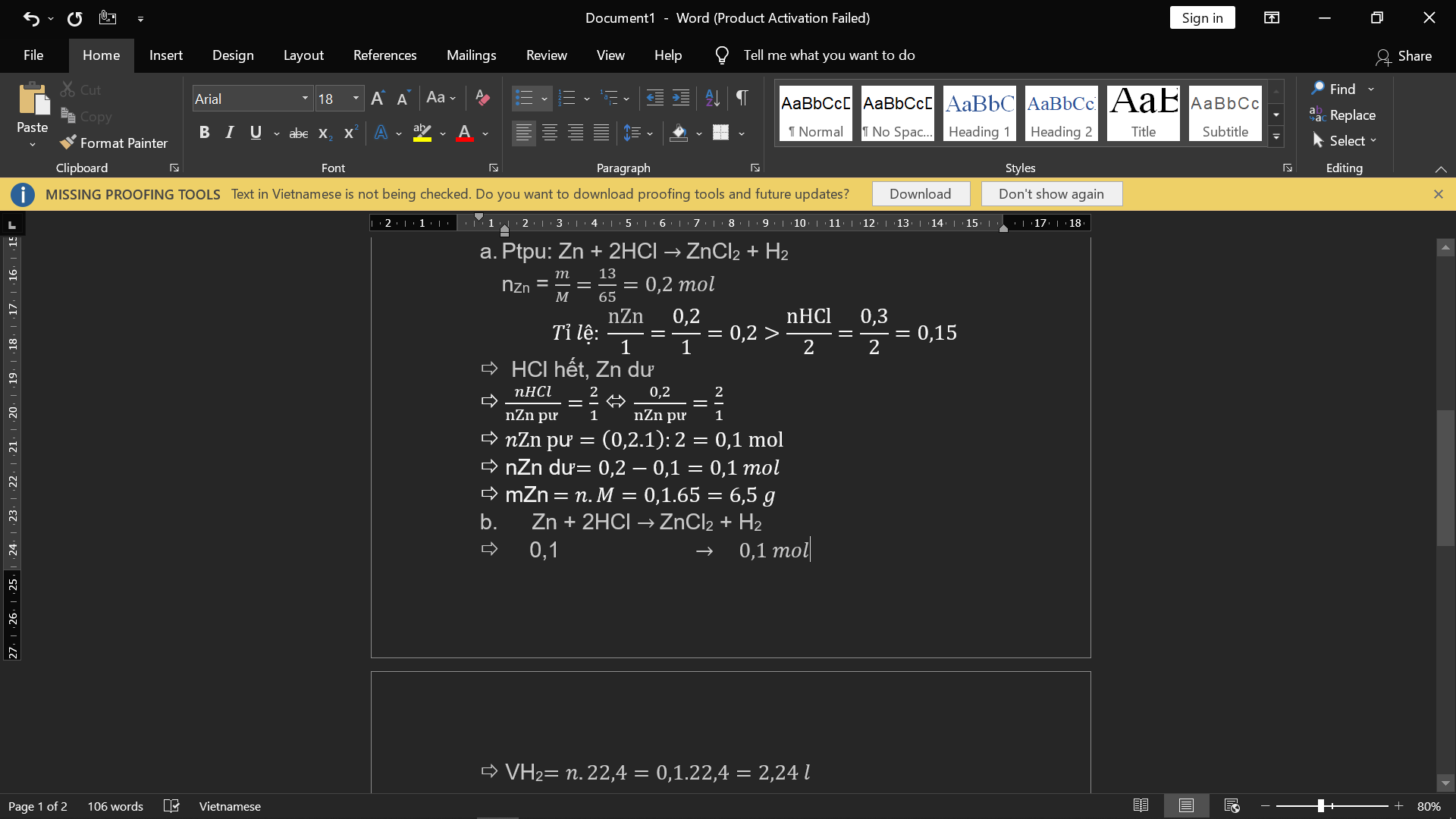
Bài 1:
a) nP=6,2/31=0,2(mol); nO2= 6,72/22,4=0,3(mol)
PTHH: 4P + 5 O2 -to-> 2 P2O5
Ta có: 0,2/4 < 0,3/5
=> P hết, O2 dư, tính theo nP
=> nO2(p.ứ)= 5/4. nP= 5/4. 0,2=0,25(mol)
=> mO2(dư)=0,3- 0,25=0,05(mol)
=> mO2(dư)=0,05.32=1,6(g)
b) nP2O5= nP/2= 0,2/2=0,1(mol)
=>mP2O5=0,1.142=14,2(g)

\(n_{hh}=\dfrac{11,2}{22,4}=0,5mol\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=x\\n_{C_2H_4}=y\end{matrix}\right.\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
x x ( mol )
\(C_2H_4+3O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\)
y 2y ( mol )
\(n_{CaCO_3}=\dfrac{80}{100}=0,8mol\)
\(Ca\left(OH\right)_2+CO_2\rightarrow\left(t^o\right)CaCO_3+H_2O\)
0,8 0,8 ( mol )
Ta có:
\(\left\{{}\begin{matrix}x+y=0,5\\x+2y=0,8\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,3\end{matrix}\right.\)
\(\%V_{CH_4}=\dfrac{0,2}{0,5}.100=40\%\)
\(\%V_{C_2H_4}=100\%-40\%=60\%\)
\(m_{tăng}=m_{Ca\left(OH\right)_2}+m_{CaCO_3}=0,8.\left(74+100\right)=139,2g\)

\(C_2H_2+\dfrac{5}{2}O_2-^{t^o}\rightarrow2CO_2+H_2O\\ CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
\(n_{C_2H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ n_{CO_2}=2n_{C_2H_2}=0,3\left(mol\right)\\ n_{H_2O}=n_{C_2H_2}=0,15\left(mol\right)\\ m_{b\uparrow}=m_{CO_2}+m_{H_2O}=0,3.44+0,15.18=15,9\left(g\right)\\ n_{CO_2}=n_{CaCO_3}=0,3\left(mol\right)\\ m_{kt}=m_{CaCO_3}=0,3.100=30\left(g\right)\)

Câu 1:
\(Mg+Br_2\rightarrow MgBr_2\\ n_{Br_2}=\dfrac{11,2}{160}=0,07\left(mol\right)=n_{Mg}=n_{MgBr_2}\\ a=m_{Mg}=0,07.24=1,68\left(g\right)\\ m_{MgBr_2}=184.0,07=12,88\left(g\right)\)
2Al+3Cl2--->2AlCl3
Khối lượng bình tăng là khối lượng của Cl2=1,7
-->n Cl2=1,7/71=0,024(mol)
Theo pthh
n Al=2/3n Cl2=0,016(mol)
m Al=0,016.27=0,432(g)