Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Nhận xét được lượng chất rắn > bột Fe nên sau phản ứng điện phân thì AgNO3 còn dư và chất rắn này
cũng có thể gồm Fe dư ( nếu không dư thì trong quá trình tính toán số mol nó = 0 thôi ).
Cả quá trình: điện phân: 2AgNO3 + H2O → 2Ag + 2HNO3 + ½.O2↑ .
Sau đó: 3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO↑ + 4.H2O. || Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓.
Quan trọng tiếp theo là chọn ẩn sao cho tính toán nhanh:
gọi số mol AgNO3 bị điện phân là x mol, số mol sắt bị hoà tan là y mol thì ta có:
Khối lượng chất rắn: 14,5 = ( 0,225 - y) × 56 + (0,15 - x ) × 108 → 108x + 56y = 14,3 gam.
Số mol sắt phản ứng: y = (0,15 - x ) ÷ 2 + 3x ÷ 8 → x ÷ 8 + y = 0,075 mol.
Vậy thời gian điện phân t = 96500 × 0,1 ÷ 2,68 = 3600 s = 1h → chọn C.

Chọn đáp án C
« Nhận xét: kết quả khi cho Fe vào Y: khối lượng rắn tăng chứng tỏ trong Y có Ag+; thu được khí NO chứng tỏ trong Y có H+; anion NO3- được bảo toàn trong Y là 0,15mol.
Gọi số mol H+ trong Y là 4x mol thì tương ứng suy luận nhanh được số lượng các chất như trên.
Bảo toàn khối lượng nguyên tố kim loại 2 vế sơ đồ:
12,6 + (0,15 – 4x) x108 =(0,075 – 1/2x)x 56 + 14,5
Giải phương trình được x = 0,045 mol → ∑ne điện phân trao đổi = 4x = 0,1mol.
Áp dụng định luật Faraday ta có thời gian điện phân t = 96500 x 0,1 : 2,68 = 3600 giây ↔ 1 giờ

Đáp án C
Nhận xét được lượng chất rắn > bột Fe nên sau phản ứng điện phân thì AgNO3 còn dư và chất rắn này
cũng có thể gồm Fe dư ( nếu không dư thì trong quá trình tính toán số mol nó = 0 thôi ).
Cả quá trình: điện phân: 2AgNO3 + H2O → 2Ag + 2HNO3 + ½.O2↑ .
Sau đó: 3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO↑ + 4.H2O.
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓.
Quan trọng tiếp theo là chọn ẩn sao cho tính toán nhanh:
gọi số mol AgNO3 bị điện phân là x mol, số mol sắt bị hoà tan là y mol thì ta có:
Khối lượng chất rắn: 14,5 = ( 0,225 - y) × 56 + (0,15 - x ) × 108 → 108x + 56y = 14,3 gam.
Số mol sắt phản ứng: y = (0,15 - x ) ÷ 2 + 3x ÷ 8 → x ÷ 8 + y = 0,075 mol.
Vậy thời gian điện phân t = 96500 × 0,1 ÷ 2,68 = 3600 s = 1h → chọn C

Đáp án B
Vì có hỗn hợp kim loại nên muối sau cùng là : Fe(NO3)2
Ta có : 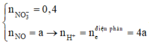
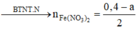
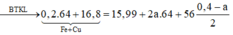
![]()

Đáp án D
+ dd AgNO 3 ⏟ 0 , 225 mol → đpdd dd Y → + 18 , 9 gam Fe 21 , 75 gam rắn T ⇒ + : x Ag + : 0 , 225 - x NO 3 - : 0 , 225 ⏟ dd Y ; NO = n H + 4 = 0 , 25 x BTE : 2 n Fe pư = 3 n NO + n Ag + ⇒ Fe pư = 0 , 1125 - 0 , 125 x n Ag ta ¨ io tha \ onh = 0 , 225 - x ⇒ m T = 18 , 9 - 56 ( 0 , 1125 - 0 , 125 x ) + 108 ( 0 , 225 - x ) = 21 , 75 ⇒ x = 0 , 15 . ⇒ T có Fe dư vào Ag Dung dịch Y có pH < 7 Ở catot nước chưa bị điện phân n electron trao đổi = n H + = 0 , 15 ⇒ t = n electron trao đôi . F I = 3600 giây + Vậy kết luận sai là Quá trình điện phân được tiến hành trong 5600 giây

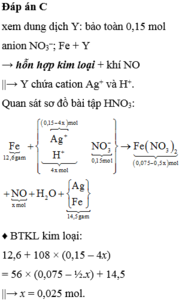

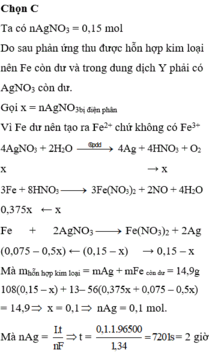


Đáp án C