Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy đổi hỗn hợp ban đầu thành Fe và O
Vì sau phản ứng còn dư kim loại => Fe chỉ bị oxi hóa lên Fe2+
Fe --> Fe2+ +2e
x...................2x
O + 2e -> O2-
y........2y
N+5 + 3e -> N+2
0,3.......0,1
Gọi x là nFe, y là nO
Ta có: 56x + 16y = 18,5 - 1,46
2x = 2y + 0,3
Giải ra: x= 0,27 mol, y = 0,12 mol
=> Khối lượng muối trong Y = 0,27 . 180 = 48,6 g
=> nHNO3 = nNO3- (trong muối) + nNO = 0,27.2 + 0,1 = 0,64 mol
=> C(HNO3) = 0,64/0,2 = 3,2 M
\(n_{NO}=\dfrac{2,24}{22,4}=0,1mol\)
3Fe3O4+28HNO3\(\rightarrow\)9Fe(NO3)3+NO+14H2O
x..........\(\rightarrow\dfrac{28x}{3}\)......\(\rightarrow\)3x........\(\rightarrow\)\(\dfrac{x}{3}\)mol
Fe+4HNO3\(\rightarrow\)Fe(NO3)3+NO+2H2O
y...\(\rightarrow\)4y........\(\rightarrow\)y.........\(\rightarrow\)y
Fe+2Fe(NO3)3\(\rightarrow\)3Fe(NO3)2
\(\dfrac{3x+y}{2}\)\(\leftarrow\)3x+y\(\rightarrow\)\(\dfrac{9x+3y}{2}\)
-Sau phản ứng còn lại 1,46 g Fe\(\rightarrow\)mX(pu)=18,5-1,46=17,04g
-Ta có hệ phương trình:
\(\left\{{}\begin{matrix}232x+56\left(y+\dfrac{3x+y}{2}\right)=17,04\\\dfrac{x}{3}+y=0,1\end{matrix}\right.\)
\(\Leftrightarrow\)\(\left\{{}\begin{matrix}316x+84y=17,04\\x+3y=0,3\end{matrix}\right.\)\(\Leftrightarrow\)\(\left\{{}\begin{matrix}x=0,03\\y=0,09\end{matrix}\right.\)
-Muối trong Y chỉ có Fe(NO3)2:\(\dfrac{9x+3y}{2}=\dfrac{9.0,03+3.0,09}{2}=0,27mol\)
\(m_{Fe\left(NO_3\right)_2}=0,27.180=46,8gam\)
\(n_{HNO_3}=\dfrac{28x}{3}+4y=\dfrac{28.0,03}{3}+4.0,09=0,64mol\)
\(C_{M_{HNO_3}}=\dfrac{n}{v}=\dfrac{0,64}{0,2}=3,2M\)

a)
Chất rắn C : Cu
Bảo toàn e :
\(2n_{Cu\ dư} = 3n_{NO}\\ \Rightarrow n_{Cu\ dư} = \dfrac{0,0175.3}{2} = 0,02625(mol)\)
Gọi
\(n_{Cu\ pư} = a; n_{Fe_3O_4} = b\\ \Rightarrow 64a + 232b = 40,8 - 0,02625.64 = 39,12(1)\)
Bảo toàn e :
\(2n_{Cu} = 2n_{Fe_3O_4} + 3n_{NO}\\ \Rightarrow 2a - 2b = 0,13.3(2)\)
Từ (1)(2) suy ra a = 0,285 ; b = 0,09
Suy ra \(n_O = 4n_{Fe_3O_4} = 0,09.4 = 0,36(mol)\)
\(2H^+ + O^{2-} \to H_2O\\ 4H^+ + NO_3^- \to NO + 2H_2O\)
\(Suy\ ra\ :n_{HNO_3} = 2n_O + 4n_{NO} = 1,24(mol)\\ \Rightarrow C_{M_{HNO_3}} = \dfrac{1,24}{0,2} = 6,2M\)
b)
Muối gồm :
Cu(NO3)2 : 0,285
Fe(NO3)2 : 0,09.3 = 0,27(mol)
\(\Rightarrow m_{muối} = 0,285.188 + 0,27.180 = 102,18(gam)\)

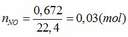
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
a → 4a → a → a (mol)
3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO + 4H2O (2)
B → 8/3b → b →2/3b (mol)
TH1: xảy ra phản ứng (1) tạo muối Fe(NO3)3 => nFe(NO3)3 = nNO = 0,03 (mol)
=> mmuối = mFe(NO3)3 = 0,03. 242 = 7,26 (g) # 7,82 => loại
TH2: xảy ra phản ứng (2) tạo muối Fe(NO3)2 => nFe(NO3)2 = 3/2 nNO = 3/2 . 0,03 = 0,045 (mol)
=> mmuối = mFe(NO3)2 = 0,045. 180 = 8,1 (g) # 7,82 => loại
TH3: xảy ra cả (1) và (2) phản ứng tạo 2 muối.
Gọi số mol của Fe ở phản ứng (1) và (2) lần lượt là a và b (mol)
Đặt vào phương trình ta có:
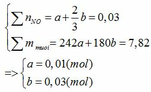
∑ nFe = 0,01 + 0,03 = 0,04 (mol) => mFe = 0,04.56 = 2,24 (g)
∑ nHNO3 pư = 4a + 8/3b = 4. 0,01 + 8/3. 0,03 = 0,12 (mol)
mHNO3 = 0,12.63 = 7,56 (g)
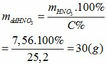
Khối lượng dd sau: mdd sau = mFe + mddHNO3 - mNO = 2,24 + 30 – 0,03.30 = 31,34 (g)
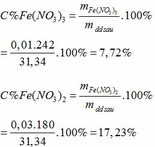

1/Bt(e); 3*nFe pư HNO3 = 3*nNO
- > nFe(3+) = 0,12 mol.
Fe +--- 2Fe(3+) -> 3Fe(2+)
0,03------0,06 mol.
nFe(3+) sau pư = 0,12 – 0,06 = 0,06 mol
2/nFeSO4 = 0,1 mol
BTE => 0,1 = 2x
=> nCl2 = 0,05 mol
m(muối) = mFeSO4 + mCl2 = 0,1.152 + 0,05.71 = 18,75 gam

nH2 = 0,13 mol; nSO2 = 0,25 mol
Ta có
2H+ + 2e → H2 Cu → Cu2+ + 2e
0,26 ←0,13 0,12 0,24
S+6 + 2e → S+4
0,5 ← 0,25
TH1: M là kim loại có hóa trị không đổi
=> nCu = (0,5 – 0,26) : 2 = 0,12 mol => mCu = 7,68g
=> mM = 3,12g (loại vì khối lượng của M lớn hơn của Cu)
TH2: M là kim loại có hóa trị thay đổi
Do M không có hóa trị I do đó khi phản ứng với HCl thì M thể hiện hóa trị II
M + 2HCl → MCl2 + H2
0,13 ← 0,13
Do M có hóa trị thay đổi => khi phản ứng với H2SO4 đặc nóng thì M thể hiện hóa trị III
2M + 6H2SO4 → M2(SO4)3 + 3SO2 + 6H2O
0,13 → 0,195
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
0,055 ← 0,055
=> mM = 10,8 – 0,055 . 64 = 7,28g
=> MM = 56 => Fe
Ta có số mol của Cu và Fe trong 10,8 g lần lượt là 0,055 và 0,13 mol
=> Trong 5,4g có số mol Cu và Fe lần lượt là 0,0275 và 0,065 mol
nAgNO3 = 0,16mol
Fe + 2AgNO3 → Fe(NO3)2 +2Ag
0,065 0,13 0,065 0,13
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,015 0,03 0,03
=> nCu dư = 0,0275 – 0,015 = 0,0125mol
m = mCu dư + mAg = 0,0125 . 64 + 0,16 . 108 = 18,08g

2yAl +3FexOy -to-> 3xFe + yAl2O3 (1)
phần 1 : Fe +4HNO3 --> Fe(NO3)3 + NO +2H2O (2)
Al2O3 + 6HNO3 --> 2Al(NO3)3 +3H2O (3)
Al +4HNO3 --> Al(NO3)3 +NO +2H2O (4)
P2 : Al2O3 +2NaOH --> 2NaAlO2 +H2O (5)
2Al +2H2O +2NaOH --> 2NaAlO2 +3H2 (6)
vì khi cho phần 2 td vs NaOH dư thấy giải phóng H2 => Al dư sau (1)
nH2=0,015(mol)
nFe(P2)=0,045(mol)
giả sử P1 gấp k lần P2
=> nFe(P1)=0,045k(mol)
theo (5) : nAl(P2)=2/3nH2=0,01(mol)
=>nAl(P1)=0,01k(mol)
nNO=0,165(mol)
theo (2,4) :nNO=(0,045k+0,01k) (mol)
=>0,055k=0,165=> k=3
=>nAl(P1)=0,03(mol)
nFe(p1)=0,135(mol)
\(\Sigma nFe=0,045+0,135=0,18\left(mol\right)\)
\(\Sigma nAl=0,03+0,01=0,04\left(mol\right)\)
mAl2O3=\(14,49-0,135.56-0,03.27=6,12\left(g\right)\)
nAl2O3(P1)=0,06(mol)
=> nAl2O3(P2)=0,02(mol)
\(\Sigma nAl2O3=0,08\left(mol\right)\)
theo (1) : nFe=3x/ynAl2O3
=> 0,18=3x/y.0,08=> x/y=3/4
=>CTHH : Fe3O4
theo (1) :nFe3O4 =1/3nFe=0,06(mol)
=>m=0,04.27+0,06.232=15(g)
bạn Lê Đình Thái ơi bạn giải nhầm tìm m rồi. Cái 0,04 mol đó là mol dư, bạn phải cộng với 0,16 mol phản ứng khi xảy ra phản ứng nhiệt phân nữa.
Kết quả là m=0,2.27+0,06.232=19,32 gam

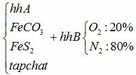
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
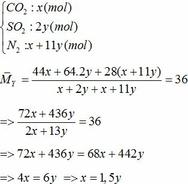
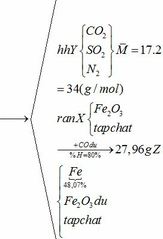
Khối lượng Fe có trong Z là:
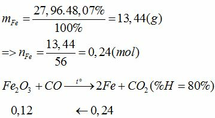
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
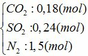
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
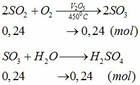
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
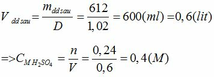

a,
\(3Cu+8HNO_3\rightarrow3Cu\left(NO_3\right)_2+2NO+4H_2O\)
\(3Fe_3O_4+28HNO_3\rightarrow9Fe\left(NO_3\right)_3+NO+12H_2O\)
\(Cu+2Fe\left(NO_3\right)_3\rightarrow Cu\left(NO_3\right)_2+2Fe\left(NO_3\right)_2\)
b,
Vì dư Cu nên Fe3+ đã bị khử hết xuống Fe2+. Muối spu gồm Cu(NO3)2, Fe(NO3)2.
\(m_{X_{pu}}=30,6-1,2=29,4\left(g\right)\)
Gọi a là mol Cu; b là mol Fe3O4
\(\rightarrow64a+232b=29,4\left(1\right)\)
\(n_{NO}=0,075\left(mol\right)\)
Fe3O4 gồm 3b mol Fe; 4b mol O
Cu lên +2, Fe lên +2
Bảo toàn e:
\(2a+6b=0,075.2+8b\)
\(\Leftrightarrow2a-2b=0,225\left(2\right)\)
\(\left(1\right)+\left(2\right)\rightarrow\left\{{}\begin{matrix}a=0,1875\\b=0,075\end{matrix}\right.\)
nHNO3= 2nCu(NO3)2+ 2nFe(NO3)2+ nNO= 0,6 mol
\(\rightarrow CM_{HNO3}=1,2M\)
Số e nhận của N là 3 sao nhân 2