Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1/Bt(e); 3*nFe pư HNO3 = 3*nNO
- > nFe(3+) = 0,12 mol.
Fe +--- 2Fe(3+) -> 3Fe(2+)
0,03------0,06 mol.
nFe(3+) sau pư = 0,12 – 0,06 = 0,06 mol
2/nFeSO4 = 0,1 mol
BTE => 0,1 = 2x
=> nCl2 = 0,05 mol
m(muối) = mFeSO4 + mCl2 = 0,1.152 + 0,05.71 = 18,75 gam

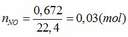
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
a → 4a → a → a (mol)
3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO + 4H2O (2)
B → 8/3b → b →2/3b (mol)
TH1: xảy ra phản ứng (1) tạo muối Fe(NO3)3 => nFe(NO3)3 = nNO = 0,03 (mol)
=> mmuối = mFe(NO3)3 = 0,03. 242 = 7,26 (g) # 7,82 => loại
TH2: xảy ra phản ứng (2) tạo muối Fe(NO3)2 => nFe(NO3)2 = 3/2 nNO = 3/2 . 0,03 = 0,045 (mol)
=> mmuối = mFe(NO3)2 = 0,045. 180 = 8,1 (g) # 7,82 => loại
TH3: xảy ra cả (1) và (2) phản ứng tạo 2 muối.
Gọi số mol của Fe ở phản ứng (1) và (2) lần lượt là a và b (mol)
Đặt vào phương trình ta có:
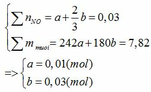
∑ nFe = 0,01 + 0,03 = 0,04 (mol) => mFe = 0,04.56 = 2,24 (g)
∑ nHNO3 pư = 4a + 8/3b = 4. 0,01 + 8/3. 0,03 = 0,12 (mol)
mHNO3 = 0,12.63 = 7,56 (g)
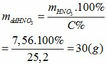
Khối lượng dd sau: mdd sau = mFe + mddHNO3 - mNO = 2,24 + 30 – 0,03.30 = 31,34 (g)
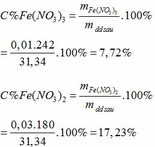


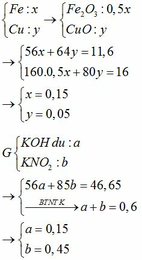
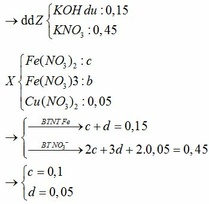

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

có n NO = 0,04 mol và dd có axit dư => ko tạo muối amoni
Al : x mol
Fe y mol
=> 27x + 56y = 1,95
3x +3y = 0,04.3
=> x =0,01 , y = 0,03
=> m Al = 0,27g, m Fe = 1,68 g
bạn gọi số mol của Fe(OH)2 : x mol
Fe(OH)3 : y mol
vì sau khi nung chỉ có Fe2O3 và Al2O3
0,015 0,0075
x + y = n Fe = 0,03 mol
n OH- = 4n Al 3+ - n kết tủa
=> 0,165 - 2x -3y = 4.0,03 - 0,015
=> 2x + 3y = 0,06
=> x = 0,03, y = 0 => Al đẩy Fe 3+ xuống Fe 2+ hoàn toàn
=> n Al tác dụng với HNO3 còn lại = 0,01 mol
=> n NO thoát ra = 0,01 mol
=> tổng n NO thoát ra = 0,05 mol
=> n HNO3 = 0,05.4 = 0,2 mol
=> Cm = 1,25 M

a, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{FeCl_2}=n_{Fe}=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(m_{FeCl_2}=0,2.127=25,4\left(g\right)\)
c, \(n_{HCl}=2n_{H_2}=0,4\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,4}{0,3}=\dfrac{4}{3}\left(M\right)\)
\(C_{M_{FeCl_2}}=\dfrac{0,2}{0,3}=\dfrac{2}{3}\left(M\right)\)

Quy đổi thành: Fe (a mol), O (b mol)
\(56a+16b=8,16\\ 3a=3\cdot\dfrac{1,344}{22,4}+2b\\ \Rightarrow a=0,12;b=0,09\\ m_{Fe\left(NO_3\right)_3}=0,12\cdot242=29,04g\)



a)
Chất rắn C : Cu
Bảo toàn e :
\(2n_{Cu\ dư} = 3n_{NO}\\ \Rightarrow n_{Cu\ dư} = \dfrac{0,0175.3}{2} = 0,02625(mol)\)
Gọi
\(n_{Cu\ pư} = a; n_{Fe_3O_4} = b\\ \Rightarrow 64a + 232b = 40,8 - 0,02625.64 = 39,12(1)\)
Bảo toàn e :
\(2n_{Cu} = 2n_{Fe_3O_4} + 3n_{NO}\\ \Rightarrow 2a - 2b = 0,13.3(2)\)
Từ (1)(2) suy ra a = 0,285 ; b = 0,09
Suy ra \(n_O = 4n_{Fe_3O_4} = 0,09.4 = 0,36(mol)\)
\(2H^+ + O^{2-} \to H_2O\\ 4H^+ + NO_3^- \to NO + 2H_2O\)
\(Suy\ ra\ :n_{HNO_3} = 2n_O + 4n_{NO} = 1,24(mol)\\ \Rightarrow C_{M_{HNO_3}} = \dfrac{1,24}{0,2} = 6,2M\)
b)
Muối gồm :
Cu(NO3)2 : 0,285
Fe(NO3)2 : 0,09.3 = 0,27(mol)
\(\Rightarrow m_{muối} = 0,285.188 + 0,27.180 = 102,18(gam)\)
mong mng không giải bảo toàn electron vì mình chưa học :'(