Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tham khảo:
| So sánh | Liên kết ion | Liên kết cộng hóa trị không có cực | Liên kết cộng hóa trị có cực |
| Giống nhau | Các nguyên tử kết hợp với nhau để tạo ra cho mỗi nguyên tử lớp electron ngoài cùng bền vững giống cấu trúc khí hiếm (2e hoặc 8e) | ||
| Khác nhau về cách hình thành liên kết | Cho và nhận electron | Dùng chung e, cặp e không bị lệch | Dùng chung e, cặp e bị lệch về phía nguyên tử có độ âm điện mạnh hơn |
| Khác nhau về nguyên tố tạo nên liên kết | Giữa kim loại và phi kim | Giữa các nguyên tử của cùng một nguyên tố phi kim | Giữa phi kim mạnh và yếu khác |

| So sánh | Liên kết ion | Liên kết cộng hóa trị không có cực | Liên kết cộng hóa trị có cực |
| Giống nhau | Các nguyên tử kết hợp với nhau để tạo ra cho mỗi nguyên tử lớp electron ngoài cùng bền vững giống cấu trúc khí hiếm (2e hoặc 8e) | ||
| Khác nhau về cách hình thành liên kết | Cho và nhận electron | Dùng chung e, cặp e không bị lệch | Dùng chung e, cặp e bị lệch về phía nguyên tử có độ âm điện mạnh hơn |
| Khác nhau về nguyên tố tạo nên liên kết | Giữa kim loại và phi kim | Giữa các nguyên tử của cùng một nguyên tố phi kim | Giữa phi kim mạnh và yếu khác |
| Nhận xét | Liên kết cộng hóa trị có cực là dạng trung gian giữa liên kết cộng hóa trị không cực và liên kết ion | ||

So sánh | Liên kết ion | Liên kết cộng hóa trị không có cực | Liên kết cộng hóa trị có cực |
Giống nhau | Các nguyên tử kết hợp với nhau để tạo ra cho mỗi nguyên tử lớp electron ngoài cùng bền vững giống cấu trúc khí hiếm ( 2e hoặc 8e ). | ||
Khác nhau về cách hình thành liên kết | Cho và nhận electron | Dùng chung e, cặp e không bị lệch | Dùng chung e, cặp e bị lệch về phía nguyên tử có độ âm điện mạnh hơn. |
Khác nhau về nguyên tố tạo nên liên kết | Giữa kim loại và phi kim | Giữa các nguyên tử của cùng một nguyên tố phi kim | Giữa phi kim mạnh yếu khác nhau |
Nhận xét | Liên kết cộng hóa trị có cực là dạng trung gian giữa liên kết cộng hóa trị không cực và liên kết ion. | ||

Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu.
Thí dụ : K+ + Cl- → KCl.
Liên kết cộng hóa trị không cực là liên kết được tạo nên giữa hai nguyên tử bằng những cặp electron chung.
Thí dụ:
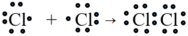
Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực
Thí dụ:
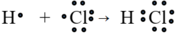
hay H – Cl

Dựa vào hiệu độ âm điện, trong:
* Na2O: liên kết ion.
* MgO: liên kết ion.
* HBr: liên kết công hóa trị phân cực.
* CaBr2: liên kết ion.



Liên kết ion được tạo thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Các xác định :
- Trong phân tử nếu cặp electron chung bị lệch hẳn về phía một nguyên tử ta sẽ có liên kết ion
- Thường được hình thành giữa kim loại điển hình và phi kim điển hình.
- Hiệu độ âm điện của hai nguyên tử trong liên kết A - B lớn hơn 1,7
Liên kết cộng hóa trị là liên kết được hình thành bằng một hay nhiều cặp electron chung.Cách xác định :
- Thường được hình thành từ hai nguyên tử phi kim có độ âm điện bằng nhau hoặc chênh nhau không nhiều (0≤ Δx≤1,7)
- Liên kết cộng hóa trị không cực : cặp electron chung không bị lệch về nguyên tử của nguyên tố nào.
- Liên kết cộng hóa trị có cực : cặp electron chung bị lệch về phía một nguyên tử(có giá trị độ âm điện lớn hơn)