Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi $n_{Fe} = a ; n_{Mg} = b; n_{Al} = c$
Ta có :
$24b = 56a(1)$
$56a + 24b + 27c = 16,14(2)$
$n_{SO_2} = 0,61(mol)$
Bảo toàn electron : $3n_{Fe} + 2n_{Mg} + 3n_{Al} = 2n_{SO_2}$
$\Rightarrow 3a + 2b + 3c = 0,61.2(3)$
Từ (1)(2)(3) suy ra a = 0,12 ; b = 0,28 ; c = 0,1
$m_{Fe} = m_{Mg} = 0,12.56 = 6,72(gam)$
$m_{Al} = 0,1.27 = 2,7(gam)$

nH2 = 0,13 mol; nSO2 = 0,25 mol
Ta có
2H+ + 2e → H2 Cu → Cu2+ + 2e
0,26 ←0,13 0,12 0,24
S+6 + 2e → S+4
0,5 ← 0,25
TH1: M là kim loại có hóa trị không đổi
=> nCu = (0,5 – 0,26) : 2 = 0,12 mol => mCu = 7,68g
=> mM = 3,12g (loại vì khối lượng của M lớn hơn của Cu)
TH2: M là kim loại có hóa trị thay đổi
Do M không có hóa trị I do đó khi phản ứng với HCl thì M thể hiện hóa trị II
M + 2HCl → MCl2 + H2
0,13 ← 0,13
Do M có hóa trị thay đổi => khi phản ứng với H2SO4 đặc nóng thì M thể hiện hóa trị III
2M + 6H2SO4 → M2(SO4)3 + 3SO2 + 6H2O
0,13 → 0,195
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
0,055 ← 0,055
=> mM = 10,8 – 0,055 . 64 = 7,28g
=> MM = 56 => Fe
Ta có số mol của Cu và Fe trong 10,8 g lần lượt là 0,055 và 0,13 mol
=> Trong 5,4g có số mol Cu và Fe lần lượt là 0,0275 và 0,065 mol
nAgNO3 = 0,16mol
Fe + 2AgNO3 → Fe(NO3)2 +2Ag
0,065 0,13 0,065 0,13
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,015 0,03 0,03
=> nCu dư = 0,0275 – 0,015 = 0,0125mol
m = mCu dư + mAg = 0,0125 . 64 + 0,16 . 108 = 18,08g

Câu 1
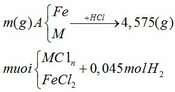
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
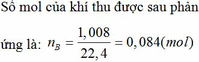
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
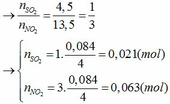
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
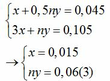
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

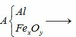
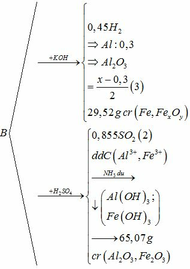
Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)
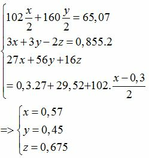
=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb
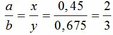
=> Fe2O3

\(n_{Mg}=x(mol);n_{Fe}=y(mol)\\ \Rightarrow 24x+56y=4(1)\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ Mg+2HCl\to MgCl_2+H_2\\ Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow x+y=0,1(2)\\ (1)(2)\Rightarrow x=y=0,05(mol)\\ \Rightarrow \%_{Fe}=\dfrac{0,05.56}{4}.100\%=70\%\\ \Rightarrow \%_{Mg}=100\%-70\%=30\%\)

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right);n_{SO_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
0,2------------------------>0,2
\(2Fe+6H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,2---------------------------------------->0,3
\(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2+2H_2O\)
0,15<--------------------------------0,15
=> \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{0,2.56+0,15.64}.100\%=53,85\%\\\%m_{Cu}=100\%-53,85\%=46,15\%\end{matrix}\right.\)

\(n_{H_2}=\dfrac{4,368}{22,4}=0,195mol\)
\(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Mg}=y\left(mol\right)\end{matrix}\right.\Rightarrow27x+24y=3,87\left(1\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(\Rightarrow1,5x+y=0,195\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,09\\y=0,06\end{matrix}\right.\)
\(m_{Al}=0,09\cdot27=2,43g\)
\(m_{Mg}=0,06\cdot24=1,44g\)

\(a)n_{H_2}=\dfrac{7,55}{22,4}=\dfrac{151}{448}mol\\ n_{Mg}=n_{Zn}=a;n_{Fe}=c\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ a.....a\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ a.....a\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ b.....b\\ \Rightarrow\left\{{}\begin{matrix}24a+65a+56b=16\\2a+b=\dfrac{151}{448}\end{matrix}\right.\\ \Rightarrow a=0,125;b=\dfrac{39}{448}\\ \%m_{Mg}=\dfrac{24.0,125}{16}\cdot100=18,75\%\\ \%m_{Zn}=\dfrac{65.0,125}{16}\cdot100=50,78\%\\ \%m_{Fe}=100-18,75-50,78=30,47\%\\ b)V_{ddH_2SO_4}=\dfrac{0,125.2+\dfrac{39}{448}}{1}\approx0,337l\)


\(n_{SO_2}=\dfrac{13,644}{22,4}=0,61\left(mol\right)\)
Đặt n Fe = x (mol) =>\(m_{Fe}=56x\)
Vì m Fe = mMg => \(n_{Mg}=\dfrac{56x}{24}=\dfrac{7}{3}x\)
nAl = y(mol)
=> 56x + 56x + 27y = 16,14 (1)
\(Fe\rightarrow Fe^{3+}+3e\) \(S^{+6}+2e\rightarrow S^{+4}\)
\(Mg\rightarrow Mg^{2+}+2e\)
\(Al\rightarrow Al^{3+}+3e\)
Bảo toàn e : 3x + \(\dfrac{7}{3}.2x\) + 3y = 0,61.2 (2)
Từ (1), (2) => x=0,12 ; y=0,1
=> mFe =mMg=0,12.56 = 6,72(g)
m Al = 0,1.27=2,7(g)