Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Ta có: 27nAl + 56nFe = 22 (1)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{19,832}{24,79}=0,8\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,4\left(mol\right)\\n_{Fe}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,4.27}{22}.100\%\approx49,09\%\\\%m_{Fe}\approx50,91\%\end{matrix}\right.\)
b, \(n_{HCl}=2n_{H_2}=1,6\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{1,6}{0,5}=3,2\left(M\right)\)

\(n_{HCl}=2.0,4=0,8(mol)\\ n_{Fe}=x(mol);n_{Al}=y(mol)\\ \Rightarrow 56x+27y=11(1)\\ Fe+2HCl\to FeCl_2+H_2\\ 2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow 2x+3y=0,8(2)\\ (1)(2)\Rightarrow x=0,1(mol);y=0,2(mol)\)
\(a,\Sigma n_{H_2}=x+1,5y=0,4(mol)\\ \Rightarrow V_{H_2}=0,4.22,4=8,96(l)\\ b,m_{Fe}=0,1.56=5,6(g);m_{Al}=0,2.27=5,4(g)\\ c,m_{dd_{HCl}}=400.1,12=448(g)\\ n_{FeCl_2}=0,1(mol);n_{AlCl_3}=0,2(mol)\\ \Rightarrow C\%_{FeCl_2}=\dfrac{0,1.127}{5,6+448-0,1.2}.100\%=2,8\%\\ C\%_{AlCl_3}=\dfrac{0,2.133,5}{5,4+448-0,3.2}.100\%=5,9\%\)

n HCl = 360 x 18,25/(100x36,5) = 1,8 mol
H 2 + CuO → t ° Cu + H 2 O
n CuO = x
Theo đề bài
m CuO (dư) + m Cu = m CuO (dư) + m Cu p / u - 3,2
m Cu = m Cu p / u - 3,2 => 64x = 80x - 3,2
=> x= 0,2 mol → m H 2 = 0,4g
Fe + 2HCl → FeCl 2 + H 2
Số mol HCl tác dụng với Fe 3 O 4 , Fe 2 O 3 , FeO là 1,8 - 0,4 = 1,4 mol
Phương trình hóa học của phản ứng:
Fe 3 O 4 + 8HCl → 2 FeCl 3 + FeCl 2 + 4 H 2 O (1)
Fe 2 O 3 + 6HCl → 2 FeCl 3 + 3 H 2 O (2)
FeO + 2HCl → FeCl 2 + H 2 O (3)
Qua các phản ứng (1), (2), (3) ta nhận thấy n H 2 O = 1/2 n HCl = 1,4:2 = 0,7 mol
Áp dụng định luật bảo toàn khối lượng, ta có:
m hỗn hợp + m HCl = m muối + m H 2 O + m H 2
57,6 + 1,8 x 36,5 = m muối + 0,7 x 18 +0,4
m muối = 57,6 + 65,7 - 12,6 - 0,4 = 110,3 (gam)

a, Ta có: 27nAl + 56nFe = 27,8 (1)
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{17,353}{24,79}=0,7\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Fe}=0,4\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{27,8}.100\%\approx19,42\%\\\%m_{Fe}\approx80,58\%\end{matrix}\right.\)
b, \(n_{H_2SO_4}=n_{H_2}=0,7\left(mol\right)\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,7}{0,5}=1,4\left(M\right)\)

\(n_{Al}=a\left(mol\right)\)
\(n_{Fe}=b\left(mol\right)\)
\(m=27a+56b=19.3\left(g\right)\left(1\right)\)
\(n_{H^+}=0.2\cdot2+0.2\cdot2.25\cdot2=1.3\left(mol\right)\)
\(2Al+6H^+\rightarrow2Al^{3+}+3H_2\)
\(Fe+2H^+\rightarrow Fe^{2+}+H_2\)
\(n_{H^+}=3a+2b=1.3\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.3,b=0.2\)
\(\%Al=\dfrac{0.3\cdot27}{19.3}\cdot100\%=41.96\%\)
\(\%Fe=58.04\%\)
\(b.\)
\(n_{H_2}=\dfrac{1}{2}n_{H^+}=0.65\left(mol\right)\)
Bảo toàn khối lượng :
\(m_{Muối}=19.3+0.4\cdot36.5+0.45\cdot98-0.65\cdot2=76.7\left(g\right)\)

a) Bảo toàn nguyên tố H : \(n_{HCl}.1=2n_{H_2}=0,6\left(mol\right)\)
=> nH2=0,3(mol)
=> \(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b) Áp dụng định luật bảo toàn khối lượng :
\(m_{ct}=m_{kl}+m_{HCl}-m_{H_2}=10,4+0,6.36,5-0,3.2=31,7\left(g\right)\)


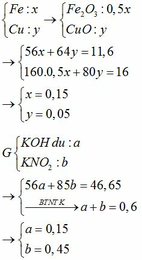
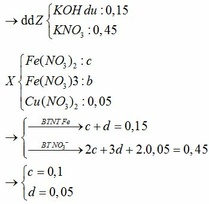

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%


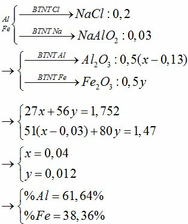

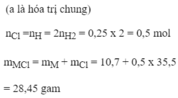

Bạn tách câu hỏi ra nhé.