Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a,\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: x x
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}65x+56y=30,7\\x+y=0,5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,3\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Zn}=\dfrac{0,3.65.100\%}{30,7}=63,52\%;\%m_{Fe}=100\%-63,52\%=36,48\%\)
b,
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,3 0,6
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,2 0,4
nHCl = 0,6+0,4 = 1 (mol)
\(V_{ddHCl}=\dfrac{1}{2}=0,5\left(l\right)=500\left(ml\right)\)

Gọi a, b lần lượt là mol của Al và Zn
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
a 1,5a
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b b
\(\Rightarrow\left\{{}\begin{matrix}27a+65b=9,2\\1,5a+b=\dfrac{5,6}{22,4}\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{0,1.27}{9,2}.100\%=29,35\%\)
\(\%m_{Zn}=\dfrac{0,1.65}{9,2}.100\%=70,35\%\)
b. \(n_{H_2}=0,25mol\) \(\Rightarrow n_{HCl}=0,5mol\)
\(\Rightarrow m_{HCl}=0,5.36,5=18,25g\)
Ta có: \(10\%=\dfrac{18,25}{m_{dd}}.100\%\)
\(\Leftrightarrow m_{dd}=182,5g\)

a, 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
x…………3/2.x
Fe + CuSO4 → FeSO4 + Cu
y……..y
Al phản ứng hết với CuSO4 sau đó Fe mới phản ứng với CuSO4. Vì sau phản ứng thu được rắn Y gồm 2 kim loại nên Al đã tan hết và Fe có thể đã phản ứng 1 phần hoặc chưa phản ứng. 2 kim loại trong Y là Fe và Cu.
⇒ nCu = nCuSO4 = 0,2.1 = 0,2 mol
⇒ mFe dư = mY - mCu = 15,68 - 0,2.64 = 2,88g
Đặt số mol Al ban đầu là x, số mol Fe phản ứng là y, ta có hệ phương trình:
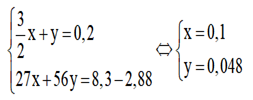
⇒ mAl = 0,1.27 = 2,7g
⇒ %mAl = 2,7/8,3.100 = 32,53%

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ PTHH:Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow n_{HCl}=2n_{H_2}=0,2(mol)\\ a,C_{M_{HCl}}=\dfrac{0,2}{0,1}=2M\\ b,n_{Fe}=n_{H_2}=0,1(mol)\\ \Rightarrow m_{Fe}=0,1.56=5,6(g)\\ \Rightarrow m_{Cu}=20-5,6=14,4(g)\\ c,\%m_{Fe}=\dfrac{5,6}{20}.100\%=28\%\\ \%m_{Cu}=100\%-28\%=72\%\)



Giải:
2Al + 3FeCl2 -> 2AlCl3 + 3Fe
x..........1,5x............x...........1,5x (mol)
Zn + FeCl2 -> ZnCl2 + Fe
y..........y..............y..........y
Theo bài:
27x + 65y = 18,4
1,5x . 56 + 56y = 28
Giải hệ pt: x = y = 0,2 mol
=> mAl = 0,2 . 27 = 5,4 g
=>%mAl = (5,4 . 100) : 18,4 = 29,35 %
=>%mZn = 100% - 29,35% = 70,65 %
Lại có: mAlCl3 = nAlCl3 . MAlCl3 = 0,2 . 133,5 = 26,7 g
mZnCl2 = nZnCl2 . MZnCl2 = 0,2 . 136 = 27,2
mdd sau pư = mhh + mdd FeCl2 - mD = 18,4 + 300 - 28=290,4 g
=>C% dd AlCl3 = (26,7 . 100) : 290,4 = 9,19%
C% dd ZnCl2 = (27,2.100) : 290,4 = 9,37%
Vậy...
Bài 1:
2Al + 3FeCl2 → 2AlCl3 + 3Fe (1)
Zn + FeCl2 → ZnCl2 + Fe (2)
a) \(n_{Fe}=\dfrac{28}{56}=0,5\left(mol\right)\)
Gọi \(x,y\) lần lượt là số mol của Al và Zn
Theo PT1: \(n_{Fe}=\dfrac{3}{2}n_{Al}=1,5x\left(mol\right)\)
Theo PT2: \(n_{Fe}=n_{Zn}=y\left(mol\right)\)
Ta có: \(\left\{{}\begin{matrix}27x+65y=18,4\\1,5x+y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
Vậy \(n_{Al}=0,2\left(mol\right)\) ; \(n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow m_{Al}=0,2\times27=5,4\left(g\right)\)
\(m_{Zn}=0,2\times65=13\left(g\right)\)
\(\Rightarrow\%m_{Al}=\dfrac{5,4}{18,4}\times100\%=29,35\%\)
\(\%m_{Zn}=\dfrac{13}{18,4}\times100\%=70,65\%\)
b) \(m_{dd}saupư=m_{hhA}+m_{ddFeCl_2}-m_{Fe}=18,4+300-28=290,4\left(g\right)\)
Theo Pt1: \(n_{AlCl_3}=n_{Al}=0,2\left(mol\right)\)
\(\Rightarrow m_{AlCl_3}=0,2\times133,5=26,7\left(g\right)\)
\(\Rightarrow C\%_{AlCl_3}=\dfrac{26,7}{290,4}\times100\%=9,19\%\)
Theo PT2: \(n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow m_{ZnCl_2}=0,2\times136=27,2\left(g\right)\)
\(\Rightarrow C\%_{ZnCl_2}=\dfrac{27,2}{290,4}\times100\%=9,37\%\)