Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(SO_3\left(0,5\right)+H_2O\left(0,5\right)\rightarrow H_2SO_4\left(0,5\right)\)
Gọi khối lượng dung dịch H2SO4 61,25% là a.
\(\Rightarrow m_{H_2SO_4\left(bđ\right)}=0,6125a\left(g\right)\)
\(n_{SO_3}=\dfrac{40}{80}=0,5\left(mol\right)\)
Khối lượng nước tham gia phản ứng là: \(0,5.18=9\left(g\right)\)
Khối lượng H2SO4 tạo thành thêm là: \(0,5.98=49\left(g\right)\)
Khối lượng của H2SO4 có sau phản ứng là: \(49+0,6125a\left(g\right)\)
Khối lượng dung dịch sau phản ứng là: \(a+40\left(g\right)\)
Theo đề bài ta có:
\(\dfrac{49+0,6125a}{a+40}=0,735\)
\(\Leftrightarrow a=160\left(g\right)\)
Vậy khối lượng dung dịch H2SO4 ban đầu là 160 (g)

SO3 + H2O --------> H2SO4
m/80...m/80...............m/80 (mol)
mct của dd mới = 500.1,2.0,245 + 49m/40 =147 + 49m/40 (g)
mdd mới = 1,2.500 + m = 600 + m (g)
=> (147 + 49m/40 )/(600 + m) = 0,49
=> m= 200(g)

Câu 1 :
Gọi $n_{SO_3} = a(mol)$
$SO_3 + H_2O \to H_2SO_4$
Sau khi pha :
$m_{dd} = 80a + 200(gam)$
$m_{H_2SO_4} = 98a + 200.9,8\% = 98a + 19,6(gam)$
Suy ra : $C\%_{H_2SO_4} = \dfrac{98a + 19,6}{200 + 80a}.100\% = 49\%$
$\Rightarrow a = 1,333(mol)$
$m_{SO_3} = 1,333.80 = 106,64(gam)$
Gọi $m_{oleum} = a(gam) ; m_{H_2SO_4} = b(gam)$
Ta có :
Sau khi trộn :
$m_{oleum} = a + b(gam)$
$m_{SO_3} = a.71\% = 0,71a(gam)$
$\Rightarrow \%SO_3 = \dfrac{0,71a}{a + b}.100\% = 62\%$
$\Rightarrow a + b = 0,4402a$
$\Rightarrow \dfrac{a}{b} = \dfrac{1}{1 - 0,4402} = 1,78$

1. \(n_{H_2SO_4\left(98\%\right)}=\dfrac{30.1,84.98\%}{98}=0,552\left(mol\right)\)
=>\(V_{H_2SO_4\left(1M\right)}=\dfrac{0,552}{1}=0,552\left(l\right)\)

PTHH: SO3 + H2O ===> H2SO4
Ta có: nSO3 = \(\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
=> mSO3 = 0,15 x 80 = 12 (gam)
Dễ dàng CM được SO3 tan hết trong H2O
=> nH2SO4 = 0,15 (mol)
=> mH2SO4 = 0,15 x 98 = 14,7 (gam)
Mặt khác, mdung dịch sau pứ = 12 + 740,4 = 752,4 (gam)
=> C% = \(\dfrac{14,7}{752,4}.100\%=1,95\%\)

Gọi n là hóa trị của M
Phản ứng xảy ra:
4M+nO2→2M2On
Giả sử số mol M là 1 mol.
→nM2On=1/2nM=0,5 mol
→mM=m=1M(M)=M(M)gam
mM2On=0,5.(2MM+16MO)=0,5(2MM+16n)=MM+8n=1,25m
→MM+8n=1,25MM→MM=32n→n=2→MM=64→M:Cu(Đồng)
Hòa tan oxit
CuO+H2SO4→CuSO4+H2O
Ta có:
mH2SO4=200.19,6%=39,2 gam
→nH2SO4=39,298=0,4 mol = nCuO=nCuSO4
→mCuO=0,4.(64+16)=32 gam;mCuSO4=0,4.(64+96)=64 gam
Áp dụng định luật bảo toàn khối lượng:
mddX=mCuO+mddH2SO4=200+32=232 gam
→C%CuSO4=64232=27,5862%
chúc bạn học tốt
Gọi n là hóa trị của M Phản ứng xảy ra: 4M+nO2→2M2On
Giả sử số mol M là 1 mol.
→nM2On=1/2nM=0,5 mol →mM=m=1M(M)=M(M)gam
mM2On=0,5.(2MM+16MO)=0,5(2MM+16n)=MM+8n=1,25m →MM+8n=1,25MM→MM=32n→n=2→MM=64→M:Cu(Đồng)

nH2SO4 = 1,8mol
H2SO4 + 3SO3 → H2SO4.3SO3 (oleum)
1,8 → 5,4
m = 5,4 . 80 = 432g

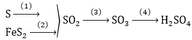

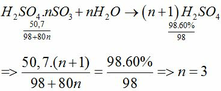

-Gọi x là số mol H2SO4 61,2%\(\rightarrow m_{dd\left(bđ\right)}=\dfrac{98x.100}{61,2}\left(g\right)\)
\(n_{H_2SO_4\left(tt\right)}=n_{SO_3}=\dfrac{40}{80}=0,5\left(mol\right)\)
\(\rightarrow n_{H_2SO_4\left(sau\right)}=x+0,5\left(mol\right)\)
\(\rightarrow m_{dd\left(sau\right)}=\dfrac{98\left(x+0,5\right).100}{73,5}\left(g\right)\)
Ta có: \(\rightarrow m_{dd\left(sau\right)}=m_{dd\left(bđ\right)}+m_{SO_3}\)
\(\Leftrightarrow\)\(\dfrac{98\left(x+0,5\right).100}{73,5}=\dfrac{98x.100}{61,2}+40\)
Giải ra x\(\approx1\left(mol\right)\)
\(\rightarrow m_{dd\left(bđ\right)}=\dfrac{98.1.100}{61,2}=160,13\left(g\right)\)