Chưng cất ethanol từ dung dịch ethanol – nước
Chuẩn bị: rượu (được nấu thủ công); bình cầu có nhánh 250 mL, nhiệt kế, ống sinh hàn nước, ống nối, ống đong 50 mL, bình tam giác 100 mL, đá bọt, nguồn nhiệt (bếp điện, đèn cồn).
Tiến hành:
- Cho 60 mL rượu được nấu thủ công vào bình cầu có nhánh (chú ý chất lỏng trong bình không vượt quá 2/3 thể tích bình), thêm vài viên đá bọt.
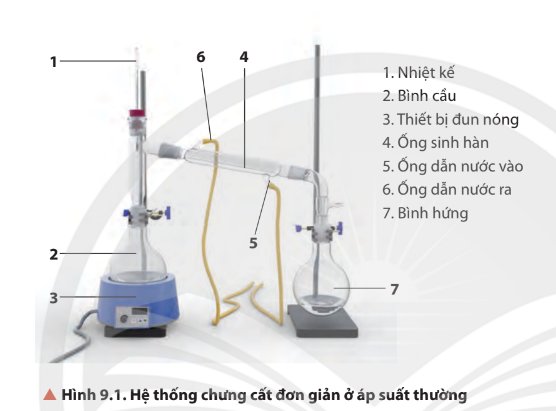
- Lắp dụng cụ như Hình 11.2.
- Đun nóng từ từ đến khi hỗn hợp sôi, quan sát nhiệt độ trên nhiệt kế thấy tăng dần, khi nhiệt độ trên nhiệt kế ổn định, đó chính là nhiệt độ sôi của hỗn hợp ethanol và nước. Khi nhiệt độ bắt đầu tăng trở lại thì tắt nguồn nhiệt, ngừng chưng cất.
Trả lời câu hỏi và thực hiện yêu cầu sau:
1. Nhiệt độ sôi của hỗn hợp ethanol ban đầu và nước là bao nhiêu? So sánh với nhiệt độ sôi của ethanol.
2. Dự đoán độ cồn của sản phẩm thay đổi như thế nào so với rượu ban đầu. Giải thích.







1. Học sinh tự làm thí nghiệm và rút ra được tosôi ethanol < tosôi hỗn hợp ethanol, nước < tosôi nước.
2. Dự đoán độ cồn của sản phẩm sẽ lớn hơn so với rượu ban đầu. Do sản phẩm thu được tinh khiết hơn lẫn ít nước hơn rượu ban đầu.