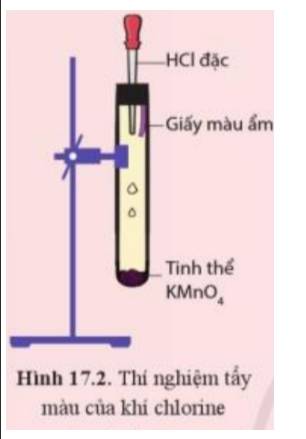
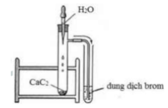
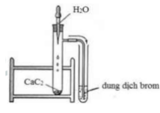
Câu 36: Quan sát ống nghiệm trước khi làm thí nghiệm chứa không khí và được chia làm 5 phần; kết thúc thí nghiêm que đóm tắt vì hết oxi, lúc đó trong ống nghiệm mực nước dâng lên 1 phần đã chiếm chỗ thể tích khí ôxi đã cháy hết. Vậy trong không khí, thể tích ôxi chiếm xấp xỉ
A.1/5
B.2/5
C.3/5
D.4/5
Câu 37: Đầu mùa mưa thường xảy ra các trận mưa axit, đó là do trong không khí có chất
A. cacbon điôxit, lưuhuỳnh điôxit.
B. khói bụi.
C. hơi nước.
D. than.
Câu 38: Vào ban đêm nhất là lúc gần sáng, ta thấy thân, lá cây ẩm ướt; có hiện tượng sương mù đó là do trong không khí có
A. hơi nước.
B. ôxi .
C. hiđrô.
D. nitơ.
Câu 39: Tài xế lái xe trên đường giữa ban ngày mà tầm nhìn bị han chế là do trong không khí có
A. khói, bụi nồng độ rất cao.
B. nắng gắt.
C. hơi nước.
D. vật phản chiếu.
Câu 40: Hiệu ứng nhà kính sẽ gây cho trái đất lũ lụt, han hán bất thường; chất gây nên hiện tượng này là
A. cacbon điôxit
B. khói bụi.
C. hơi nước.
D. chất dễ cháy.