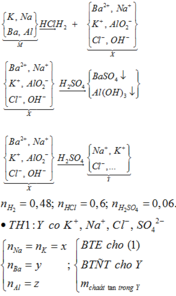
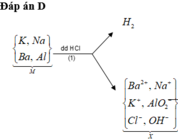
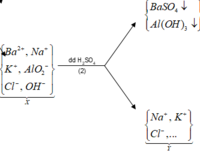
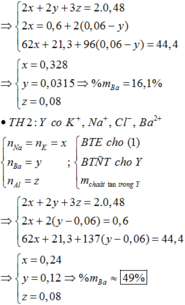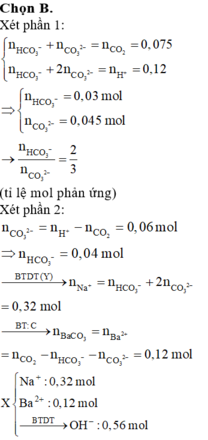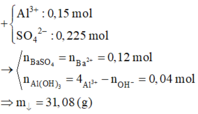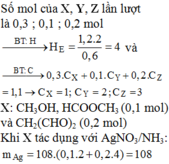Cho hỗn hợp M gồm Ba, Na, K, Al (Na và K có số mol bằng nhau) tác dụng hết với 300 ml dung dịch HCl 2M, sau phản ứng thu được dung dịch X trong suốt và 10,752 lít H2 (đktc). Nhỏ từ từ 150 ml dung dịch H2SO4 0,4M vào dung dịch X thì lượng kết tủa Al(OH)3 đạt giá trị cực đại. Lọc bỏ kết tủa và cô cạn dung dịch còn lại thì thu được 44,4 gam muối khan. Phần trăm khối lượng của Ba trong M gần nhất với giá trị nào sau đây?
A. 49%.
B. 53%.
C. 48%.
D. 31%.