Cho 11 gam hỗn hợp X chứa Al và Fe phản ứng hoàn toàn với 1 lít dung dịch CuCl2 0,5M. Sau phản ứng tạo ra dung dịch A và chất rắn B, gam. Cho dung dịch A phản ứng hoàn toàn với dung dịch NaOH dư thu được kết tủa E, nung E trong không khí đến khối lượng không đổi thu được hỗn hợp F gồm 2 chất rắn. Khối lượng của F là
A. 16 gam
B. 26 gam
C. 14,8 gam
D. 16,4 gam


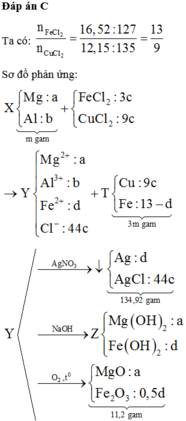

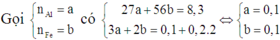
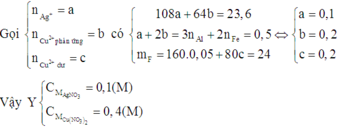
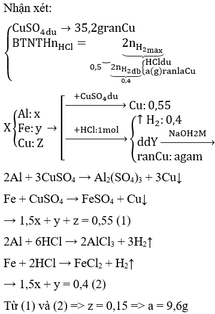

Đáp án A