Cho hỗn hợp gồm 2,7 gam Al và 2,8 gam Fe vào 550 ml dung dịch AgNO3 1M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
A. 32,4
B. 48,6
C. 54,0
D. 43,2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

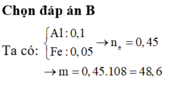

Đáp án A
nAl = 2,7 : 27 = 0,1 mol , nFe = 5,6 : 56 = 0,1 mol ,nAgNO3 = 0,55.1 = 0,55 mol
Khi cho hỗn hợp kim loại gồm Al , Fe vào dung dịch AgNO3 thì Al sẽ phản ứng trước nếu Al hết sẽ đến Fe phản ứng , nếu AgNO3 dư sau phản ứng với Fe thì có phản ứng:
Ag+ + Fe2+ → Ag + Fe3+
Al + 3AgNO3 à Al(NO3)3 + 3Ag (1)
Ban đầu 0,1 0,55
Phản ứng 0,1 0,3 0,3
Kết thúc 0 0,25 0,3
Al hết ⇒ Tính theo Al , = 3.nAl ⇒ AgNO3 dư : 0,55 – 3.0,1 = 0,25 mol
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (2)
Ban đầu 0,1 0,25
Phản ứng 0,1 0,2 0,1 0,2
Kết thúc 0 0,05 0,1 0,2
⇒ Sau phản ứng AgNO3 dư : 0,05 mol tiếp tục có phản ứng
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag (3)
Ban đầu 0,1 0,05
Phản ứng 0,05 0,05 0,1
Kết thúc 0,05 0 0,1
Từ (1) , (2) , (3) tổng số mol Ag = 0,3+ 0,2 + 0,05 = 0,55 ⇒ mAg = 0,55.108 = 59,4 gam

Tính số mol từng chất trong hỗn hợp và số mol dd. Viết pt Al + AgNO3 trước ( vì Al mạnh hơn Fe ) . Tính số mol AgNO3 đã phản ứng. Phần còn lại sẽ phản ứng với Fe. Chất rắn còn lại gồm Ag sinh ra và có thể còn Fe dư

Đáp án : D
nAl = 0,2 mol ; nFe = 0,2 mol ; nAgNO3 = 0,8 mol
Các phản ứng có thể xảy ra :
Al + 3Ag+ -> Al3+ + 3Ag
Fe + 2Ag+ -> Fe2+ + 2Ag
Fe2+ + Ag+ -> Fe3+ + Ag
=> nAg = 0,8 mol
=> nFe dư = 0,2 – 0,1 = 0,1 mol
=> mrắn = 0,8.108 + 0,1.56 = 92g