Cho KI tác dụng với K M n O 4 trong môi trường H 2 S O 4 , thu được 1,51 gam M n S O 4 . Số mol I 2 tạo thành và KI tham gia phản ứng là
A. 0, 025 và 0,050
B. 0,030 và 0,060
C. 0,050 và 0,100
D. 0,050 và 0,050
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Bước đầu tiên, cần hoàn thành phương trình phản ứng với đầy đủ các chất và hệ số:
![]()
![]()
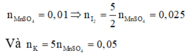
Nhận xét: Ngoài việc viết đầy đủ phản ứng như trên, các bạn vẫn có thể giải quyết bài toán bằng việc áp dụng định luật bảo toàn moi electron và bảo toàn nguyên tố:

Áp dụng định luật bào toàn mol electron, ta có:
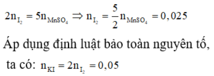

Đáp án B
Bước đầu tiên, cần hoàn thành phương trình phản ứng với đầy đủ các chất và hệ số:
![]()
![]()
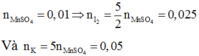
Nhận xét: Ngoài việc viết đầy đủ phản ứng như trên, các bạn vẫn có thể giải quyết bài toán bằng việc áp dụng định luật bảo toàn moi electron và bảo toàn nguyên tố:
Quá trình nhường electron:

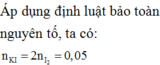

1) giả sử kl đá vôi là 100g --> kl CaCO3 là 80g
Giả sử lượng CaCO3 pu là a
CaCO3 --> CaO + CO2
a a a
kl CaO: 56a
kl chất rắn sau pu: 100 - 44a
-> a = 0.6 mol
-> mCaCO3 pu= 60 (g)
-> H = 60 / 80 = 75%
2) Đặt nCu= x; nFe= y; nAl= z trong 23,8g hh
ta có pt: 64x + 56y + 27z = 23,8 (1)
Cu + Cl2 -> CuCl2
x---> x
2Fe +3 Cl2 -> 2FeCl3
y--> 1,5y
2 Al + 3 Cl2 -> 2AlCl3
z--> 1,5z
khi đó: nCl2 = x+ 1,5y + 1,5z = 14,56/22,4 (2)
Đặt nCu=k x; nFe= ky; nAl= kz trong 0,25 mol hh
-> Ta có pt: kx+ ky + kz= 0,25 (3)
PTHH: Fe +2 HCl -> FeCl2 + H2
ky--> ky
2Al + 6HCl -> 2AlCl3 +3H2
kz--> 1,5kz
ta có: nH2 = ky + 1,5kz= 0,2 (4)
Lấy (3) chia (4) ta đc pt: (x+ y + z) /(y+ z) = 0,25/0,2 (5)
giải pt (1)(2) (5) ta tìm đc x,y, z
=> tìm đc phần trăm theo khối lượng mỗi chất trong hh ban đầu

Đặt a,b là số mol Fe3O4 và Cu
=> %O = \(\dfrac{16\cdot4a}{232a+64b}=25,8\%\)
bảo toàn e
a+2b=5.0,006.10
=> a=0,1997 và b=0,0501
=> m=49,54(gam)

17Câu hỏi của Thùy Trang - Hóa học lớp 10 | Học trực tuyến
18
Dùng phương pháp đường chéo:
Chọn A
Số mol MnSO4 = 0,01 mol
Ta có các quá trình: