Cho dung dịch chứa 0,1 mol (NH4)2CO3 tác dụng với dung dịch chứa 34,2 gam Ba(OH)2. Sau phản ứng thu được m gam kết tủa. Giá trị của m là:
A. 19,7
B. 39,4
C. 17,1
D. 15,5
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Lượng CO 2 tham gia phản ứng và lượng Ba ( OH ) 2 ở hai thí nghiệm đều bằng nhau, nhưng ở TN1 thu được lượng kết tủa ít hơn ở TN2. Suy ra ở TN1 kết tủa đã bị hòa tan một phần. Dựa vào tính chất của đồ thị ở TN1 suy ra :
n CO 2 = 2 n Ba ( OH ) 2 - n BaCO 3 = ( 2 a - 0 , 1 ) mol
Đồ thị biểu diễn sự biến thiên lượng kết tủa theo lượng CO 2 ở TN1 và TN2 :
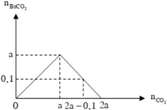
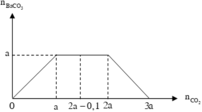
Dựa vào 2 đồ thị, ta thấy a < 2a - 0,1 < 2a nên ở TN2 kết tủa đạt cực đại. Suy ra :
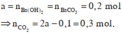
Vậy V = 6,72 lít và a = 0,2 mol

Chọn D
nCO2 dùng ở 2 thí nghiệm là như nhau nhưng TN2 cho nhiều BaCO3 hơn TN1
Þ Trong dung dịch sau phản ứng của TN1 còn Ba2+ cùng với CO32− hoặc HCO3-
Þ Dung dịch sau phản ứng của TN1 chỉ có Ba(HCO3)2.
Vậy ở TN1 bản chất là giống thí nghiệm 1 tạo ra 0,1 mol BaCO3 và dung dịch có a – 0,1 mol Ba(HCO3)2
Lượng NaOH thêm vào là a > nBa(HCO3)2 Þ Toàn bộ Ba2+ đã kết tủa
Þ a – 0,1 = 0,1 Þ a = 0,2; BTNT.C Þ nCO2 = 0,1 + 0,1.2 = 0,3 Þ V = 6,72.

Đáp án B
Gọi số mol các ion K+, HCO3-, Cl- và Ba2+ có trong 100 ml dung dịch lần lượt là x, y, z, t mol
-Phần 1: HCO3-+ OH-→ CO32-+ H2O
y y y
Ba2++ CO32-→ BaCO3
t y t mol = 0,1 mol
-Phần 2:
HCO3-+ OH-→ CO32-+ H2O
y y y
Ba2++ CO32-→ BaCO3
y y = 0,15
-Phần 3:
Ag++ Cl-→ AgCl
2z 2z = 0,2 mol suy ra z = 0,1 mol
Theo ĐLBT ĐT thì: x+2t=y+z suy ra x=0,05 mol
đun sôi đến cạn 50 ml dung dịch X thì khối lượng chất rắn khan thu được là
(39x+ 61y + 35,5.z+ 137t)/2= 14,175 gam

Đáp án A
Số mol OH- = 0,5 . 0,4 = 0,2 mol mà số mol kết tủa Fe(OH)3 = 0,05 mol
Nên có 0,15 mol OH- tạo kết tủa và 0,05 mol OH- trung hòa lượng H+ còn lại.
Vậy số mol OH- dư trong Y là 0,05 . 2 = 0,1 mol → nên số H+ phản ứng là 0,6 mol H+.
Lập hệ số mol Fe là x ; Fe3O4 là y
⇒ 56x + 232y = 10,24
Bảo toàn e cho nhận: 3x + y = 0,3 + a
Số mol H+ phản ứng: 4.nNO + 2.nNO2 + 8.nFe3O4= 0,6 mol
→ 4.0,1 + 2a + 8y =0,6
Giải hệ ta được: a = 0,02; x = 0,1; y = 0,02 mol
Vậy nếu phản ứng với Ba(OH)2 dư thì sẽ có 0,08 mol Fe(OH)3; 0,05 mol BaSO4
Nên khối lượng là: 20,21 gam. (Chia 2 vì chỉ lấy 1 nửa dung dịch).

Chọn A
nOH- = 0,06x2 = 0,12 > nNH3 = 0,08 Þ OH- dư Þ Trong X có chứa nNH4+ = 0,08
BTĐT => n S O 4 2 - = (0,12 + 0,08 - 0,l)/2 = 0,05 < nBa2+ = 0,06 Þ Có 0,05 mol BaSO4 kết tủa
Þ Trong Z có nBa2+ = 0,06 - 0,05 = 0,01; nK+ = 0,12; nCl- = 0,1; nOH- = 0,12 - 0,08 = 0,04
Vậy m = 0,01x137 + 0,12x39 + 0,1x35,5 + 0,04x17 = 10,28.

Chọn B
Bảo toàn điện tích có: 0,1 + 0,15 = 0,1 + 2x → x = 0,075 mol
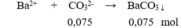
m↓ = 0,075.197 = 14,775 gam.
Đáp án A
(NH4)2CO3 + Ba(OH)2→ BaCO3↓ + 2NH3+ 2H2O
0,1 mol 0,2 mol 0,1 mol
mBaCO3= 0,1.197= 19,7 gam