Nhúng thanh sắt có khối lượng 50 gam vào 500 ml dung dịch CuSO 4 . Sau một thời gian khối lượng thanh sắt tăng 4%. Xác định lượng Cu thoát ra và nồng độ mol của dung dịch sắt sunfat.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Theo (1) có khối lượng Cu bám vào: mCu = 0,4.2,5.64 = 64 (gam)
Theo (2) có khối lượng Cu bám vào: mCu = 0,4.64 =25,6 (gam).
Đáp án A

a, Cứ 1 mol sắt tan trong dd thì sẽ có 1 mol Cu bám vào thanh sắt ⇒ Khối lượng tăng 8g
Vậy khi khối lượng tăng 0,8g thì nCu = nFe = 0.1 (mol)
⇒ mCu trên thanh sắt = 6,4 (g)
b, Các chất tan trong A: CuSO4; FeSO4
V = 500 ml = 0,5 (l)
nCuSO4 ban đầu = 0,5 (mol)
nCuSO4 phản ứng = 0,1 (mol)
⇒ nCuSO4 trong dd = 0,4 (mol)
⇒ CMCuSO4 = 0.8 (M)
nFeSO4 = nFe = 0,1 (mol)
⇒ CMFeSO4 = 0,2 (M)
PTHH: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
a) Gọi số mol Fe phản ứng là \(x\) \(\Rightarrow n_{Cu}=x\left(mol\right)\)
Ta có: \(64x-56x=0,8\) \(\Leftrightarrow x=0,1\)
\(\Rightarrow m_{Cu\left(bámvào\right)}=0,1\cdot64=6,4\left(g\right)\)
b) Ta có: \(n_{CuSO_4}=0,5\cdot1=0,5\left(mol\right)\)
\(\Rightarrow n_{CuSO_4\left(dư\right)}=0,5-0,1=0,4\left(mol\right)\)
Mặt khác: \(n_{FeSO_4}=0,1mol\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{CuSO_4}}=\dfrac{0,4}{0,5}=0,8\left(M\right)\\C_{M_{FeSO_4}}=\dfrac{0,1}{0,5}=0,2\left(M\right)\end{matrix}\right.\)

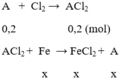
số mol FeCl2 là n = 0,25 . 0,4 = 0,1 (mol)
gọi x là số mol Fe phản ứng
khối lượng kim loại tăng là Δm = mA - mFe = Ax – 56x = 0,8
x = 0,1 → A.0,1 – 56.0,1 = 0,8 → A = 64. A là Cu
số mol Cu là nCu = 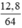 = 0,2 (mol)
= 0,2 (mol)
số mol CuCl2 → n(CuCl2) = nCu = 0,2 (mol)
nồng độ mol/l CuCl2 là C(M(CuCl2)) = 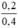 = 0,5M
= 0,5M

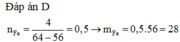
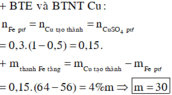



Khối lượng thanh sắt tăng: 50x4/100 = 2(g). Gọi khối lượng sắt tác dụng là x gam
Phương trình hóa học của phản ứng:
Fe + CuSO 4 → FeSO 4 + Cu
Theo phương trình hóa học trên và đề bài, ta có:
64x/56 - x = 2
=> x= 14g; n Fe = 14/56 = 0,25 mol
Vậy khố lượng Cu sinh ra là 16 gam
Fe + CuSO 4 → FeSO 4 + Cu
n FeSO 4 = n Fe = 0,25
C M FeSO 4 = 0,25/0,5 = 0,5M