Để xác định thành phần phần trăm khối lượng của hỗn hợp A gồm bột nhôm và bột magie, người ta thực hiện hai thí nghiệm sau:
– Thí nghiệm 1: cho m gam hỗn hợp A tác dụng hết với dung dịch HCl loãng dư, thu được 5,6 lít khí ở đktc.
– Thí nghiệm 2: cho m gam hỗn hợp A tác dụng với dung dịch NaOH dư, thu được 3,36 lít khí ở đktc. Tính phần trăm khối lượng của mỗi chất trong hỗn hợp A.



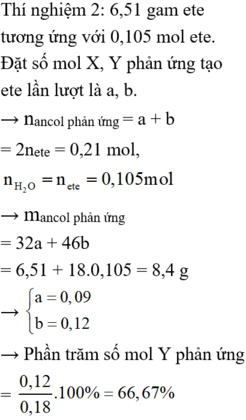

Gọi số mol của Al và Fe lần lượt là a và b
Ta có 1,5a + b = 0,25
1,5a = 0,15
=> a = 0,1 và b = 0,1
=> %Al = 32,53%
%Fe= 67,47%