Hai nguyên tố X và Y cùng một chu kì trong bảng tuần hoàn các nguyên tố hóa học, X thuộc nhóm IIA, Y thuộc nhóm IIIA ( Z X + Z Y = 51 ).
Phát biểu nào sau đây đúng?
A. Kim loại X không khử được ion Cu 2 + trong dung dịch.
B. Hợp chất với oxi của X có dạng X 2 O 7 .
C. Trong nguyên tử nguyên tố X có 25 proton.
D. Ở nhiệt độ thường X không khử được H 2 O .





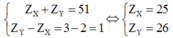
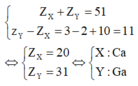

Đáp án A