Trộn 3 dung dịch HCl 0,3M; H2SO4 0,2M; và H3PO4 0,1M với những thể tích bằng nhau thu được dung dịch X. Để trung hòa 300 ml dung dịch X cần vừa đủ V ml dung dịch Y gồm NaOH 0,2M và Ba(OH)2 0,1M. Giá trị của V là
A. 1000.
B. 500.
C. 200.
D. 250.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHCl(1)=0,5.0,2=0,1 mol
nHCl(2)=0,2.0,3=0,06 mol
VddHCl sau khi trộn=500+200=700ml=0,7 lít
Tổng nHCl sau khi trộn=0,1+0,06=0,16 mol
CM dd HCl sau khi trộn=0,16/0,7=0,23M

Đáp án A
Gọi thể tích dung dịch A là V1 lít. Có nH+ = ( 0,2+0,3+0,1.2+0,3).V1 = V1 mol
Gọi thể tích dung dịch B là V2 lít. Có nOH- = ( 0,3+ 0,4+ 0,15.2).V2 = V2 mol
H+ + OH- → H2O
V1 V2
Dung dịch thu được có pH = 13 nên OH- dư
nOHdư = V2- V1 mol
[OH-]dư = (V2-V1)/(V2+ V1) = 10-1 suy ra V1: V2 = 11:9

Chọn B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
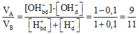

Đáp án B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
VA/VB = (1-0,1)/(1+0,1) = 9/11

\(n_{NaOH}=0,1.0,2=0,02\left(mol\right)\\ n_{HCl}=0,3.0,1=0,03\left(mol\right)\\ NaOH+HCl\rightarrow NaCl+H_2O\\ Vì:\dfrac{0,02}{1}< \dfrac{0,03}{1}\Rightarrow HCldư\\ n_{HCl\left(dư\right)}=0,03-0,02=0,01\left(mol\right)\\ \left[H^+\right]=\left[HCl_{dư}\right]=\dfrac{0,01}{0,1+0,1}=0,05\left(M\right)\\ \Rightarrow D\)

Gọi thể tích dung dịch X là V1 lít. Có nH+ = ( 0,2+0,3+0,1.2+0,3).V1 = V1 mol
Gọi thể tích dung dịch Y là V2 lít. Có nOH- = ( 0,3+ 0,4+ 0,15.2).V2 = V2 mol
H+ + OH- → H2O
V1 V2
Dung dịch thu được có pH = 13 nên OH- dư
nOHdư = V2- V1 mol
[OH-]dư = (V2-V1)/(V2+ V1) = 10-1 suy ra V1: V2 = 11:9

Đáp án B
Ta có: nHCl = 0,036 mol, nHNO3 = 0,036 mol, nH2SO4 = 0,024 mol
⇒ ∑nH+ = 0,12 mol || ∑nOH– = 0,08×2×V + 0,23×V = 0,39V.
+ Vì pH = 2 ⇒ Sau pứ trung hòa nH+ dư = 102×(0,36+V) = 0,01V + 0,0036
+ Ta có: ∑nH+ = ∑nOH– + nH+ dư Û 0,12 = 0,39V + 0,01V + 0,0036.
⇔ V = 0,291 lít ⇒ nBa(OH)2 = 0,02328 mol.
+ Vì nBa2+ < nSO42– ⇒ m↓ = mBaSO4 = 0,02328×233 ≈ 5,42 gam

Đáp án B
Ta có: nHCl = 0,036 mol, nHNO3 = 0,036 mol, nH2SO4 = 0,024 mol
⇒ ∑nH+ = 0,12 mol || ∑nOH– = 0,08×2×V + 0,23×V = 0,39V.
+ Vì pH = 2 ⇒ Sau pứ trung hòa nH+ dư = 102×(0,36+V) = 0,01V + 0,0036
+ Ta có: ∑nH+ = ∑nOH– + nH+ dư ⇔ 0,12 = 0,39V + 0,01V + 0,0036.
Û V = 0,291 lít ⇒ nBa(OH)2 = 0,02328 mol.
+ Vì nBa2+ < nSO42– ⇒ m↓ = mBaSO4 = 0,02328×233 ≈ 5,42 gam
Đáp án D
VX = 0,3 lit
=> Thể tích mỗi dung dịch axit thành phần là 0,1 lit
=> nH+ = nHCl + 2nH2SO4 + 3nH3PO4 = 0,1.0,3 + 2.0,1.0,2 + 3.0,1.0,1 = 0,1 mol
Để trung hòa thì : nH+ = nOH- = 0,1 mol
Có : nOH- = nNaOH + 2nBa(OH)2 = (0,2 + 0,1.2).V.10-3 = 0,1 mol
=> V = 250 ml