Cho một hỗn hợp gồm Al và Ag phản ứng với dung dịch axit H2SO4 loãng thu được 6,72 lít H2 (đktc). Sau phản ứng thì còn 3 gam một chất rắn không tan. Xác định thành phần % theo khối lượng của Al trong hỗn hợp ban đầu.
A. 35,7%.
B. 64,3%.
C. 26,8%.
D. 73,2%






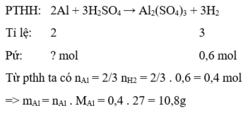

m(rắn)=mAg=3(g); nH2=6,72/22,4=0,3(mol)
2 Al +3 H2SO4 -> Al2(SO4)3 + 3 H2
nAl=2/3. 0,3=0,2(mol) => mAl=0,2.27=5,4(g)
=> \(\%mAl=\dfrac{5,4}{5,4+3}.100\approx64,3\%\)
=> CHỌN B
\(n_{H_2}=0,3\left(mol\right)\)
\(2Al+3H_2SO_{4\left(l\right)}\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2<---------------------------------------0,3
\(m_{Al}=0,2.27=5,4\left(g\right)\)
\(m_{r_{bđ}}=5,4+3=8,4\left(g\right)\)
\(\%m_{Al}=\dfrac{5,4.100\%}{8,4}\approx64,3\%\)
=>B