Hòa tan hoàn toàn m gam CuO trong 122,5 gam dung dịch H2 SO4 loãng có nồng độ C%. Sau phản ứng thu được dung dịch X. Ngâm 1 lá sắt vào dung dịch X không thấy khí bay ra và khi dung dịch X không còn màu xanh, người ta Lấy lá sắt ra rửa nhẹ, sấy khô, cân lại thấy khối lượng lá sắt tăng 2 gam. Biết các phản ứng xảy ra hoàn toàn và toàn bộ Cu sinh ra đều bám trên lá sắt.
a) Tính m và C.
b) Tính nồng độ phần trăm của dung dịch sau khi lấy lá sắt ra.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

refer
a)CuO+H2SO4→CuSO4+H2OCuO+H2SO4→CuSO4+H2O
CuSO4+Fe→FeSO4+CuCuSO4+Fe→FeSO4+Cu
b)
Khối lượng lá sắt tăng lên chính là khối lượng sắt bị hòa tan ( trừ đi) và khối lượng Đồng bám vào( tăng lên)
nCuO=1,664−56=0,2 molnCuO=1,664−56=0,2 mol
mCuO=0,2.80=16gmCuO=0,2.80=16g
c) Theo PTHH ta có:
→nH2SO4=0,2 mol→nH2SO4=0,2 mol
mH2SO4=0,2.98=19,6gmH2SO4=0,2.98=19,6g
C%=mH2SO4mdd=19,698.100=20%C%=mH2SO4mdd=19,698.100=20%
d) theo PTHH ta có:
nFeSO4=nCu=0,2 molnFeSO4=nCu=0,2 mol
BTKL:mCuO+mddH2SO4+mFePU−mCu=16+98+0,2.56−0,2.64=112,4gBTKL:mCuO+mddH2SO4+mFePU−mCu=16+98+0,2.56−0,2.64=112,4g
C%FeSO4=0,2.152112,4.100=27,04%

Đáp án C
Vì Z chứa hai muối nên Z chứa Zn(NO3)2 và Al(NO3)3.
Ngâm T trong H2SO4 loãng không thấy khí thoát ra nên T chứa Cu và Ag.
Do đó các chất đều phản ứng vừa hết.
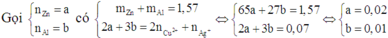
Vậy tổng nồng độ các ion trong Z là
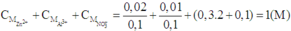

a) PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
Ta có: \(n_{SO_3}=\dfrac{24}{80}=0,3\left(mol\right)=n_{H_2SO_4}\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,3\cdot98}{20\%}=147\left(g\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{147}{1,14}\approx128,95\left(ml\right)\)
b) PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Theo PTHH: \(n_{Fe}=n_{H_2SO_4}=n_{H_2}=0,3\left(mol\right)=n_{FeSO_4}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,3\cdot56=16,8\left(g\right)\\V_{H_2}=0,3\cdot24,76=7,428\left(l\right)\\m_{FeSO_4}=0,3\cdot152=45,6\left(g\right)\\m_{H_2}=0,3\cdot2=0,6\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{Fe}+m_{ddH_2SO_4}-m_{H_2}=163,2\left(g\right)\)
\(\Rightarrow C\%_{FeSO_4}=\dfrac{45,6}{163,2}\cdot100\%\approx27,94\%\)

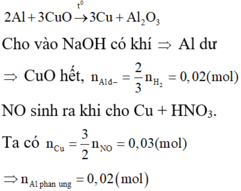


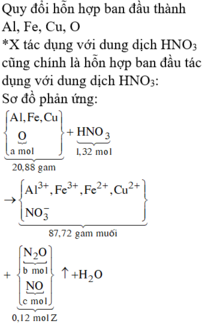
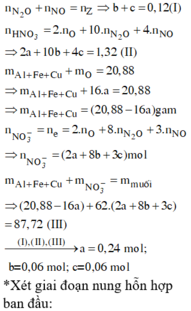
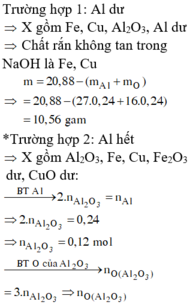
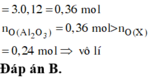

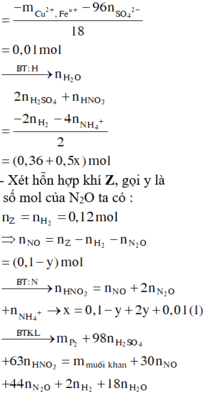


a) Khi ngâm lá sắt vào dung dịch X thì không thấy khí thoát ra nên Cuo và H2SO4 phản ứng vừa đủ với nhau .
\(CuO+H_{2^{ }_{ }}SO_{4_{ }}\rightarrow CuSO_{4_{ }}+H_2O\left(1\right)\)
Khi dung dịch X không còn màu xanh thì CuSO4 đã phản ứng hết
\(CuSO_4+Fe\rightarrow FeSO_{4_{ }}+Cu\left(2\right)\)
Theo phản ứng (1) và (2)
\(n_{Cuo}=n_{H_2SO_4}=n_{CuSO_4}=n_{Cu}=\frac{2}{64-56}=0,25\left(mol\right)\)
Nồng độ phần trăm của dung dịch H2SO4
\(C\%_{H_2SO_4}=\frac{0,25.98}{122,5}.100\%=20\%\Rightarrow C=20\)
b) Khối lượng của dung dịch sau phản ứng:
\(m_{dd}=m_{CuO}+m_{ddH_2SO_4}-\left(m_{Cu}-m_{Fe}\right)=20+122,5-2=140,5\left(g\right)\)
Theo phản ứng (2) :
\(n_{FeSO_4}=n_{Cu}=0,25\left(mol\right)\Rightarrow m_{FeSO_4}=0,25.152=38\left(g\right)\)
Nồng độ phần trăm của dung dịch sau khi lấy sắt ra là:
\(C\%_{FeSO_4}=\frac{38}{140,5}.100\%=27,05\%\)