nung nóng 3,72 g hỗn hợp bột các kim loại Zn và Fe trong bột S dư , Chất rắn thu được sau phản ứng được hòa tan hoàn toàn bằng dung dịch H2SO4 loãng , nhận thấy có 1,334 lít khi ( điều kiện tiêu chuẩn ) thoát ra : a) viết phương trình hóa học của các phản ứng đã xảy ra ; b) xác định khối lượng mỗi kim loại trong hỗn hợp ban đầu .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
Phương trình hóa học của phản ứng:
Zn + S → ZnS
Fe + S → FeS
ZnS + H2SO4 → ZnSO4 + H2S
FeS + H2SO4 → H2S + FeSO4

Đặt nZn = x mol; nFe = y mol.
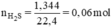
Ta có hệ phương trình: 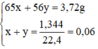
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Theo đề bài ta có bột S dư nên Fe, Zn tác dụng hết với S.
a)Phương trình hóa học của phản ứng.
Zn + S -> ZnS Fe + S -> FeS
x mol x mol y mol y mol
ZnSO4 + H2SO4 -> ZnSO4 + H2S
x mol x mol
FeSO4 + H2SO4 -> FeSO4 + H2S
x mol y mol
Ta có hệ phương trình :
Giải hệ phương trình => x = 0,04 (mol), y = 0,02 (mol).
Vậy mZn = 0,04.65 = 2,6g
mFe = 0,02.56 = 1,12g.

nH2S = 2.24/22.4 = 0.1 (mol)
ZnS + H2SO4 => ZnSO2 + H2S
0.1____________________0.1
Zn + S -to-> ZnS
0.1________0.1
mZn = 0.1*65 = 6.5 (g)

a) Zn + S ---> ZnS; Fe + S ---> FeS;
ZnS + H2SO4 ---> ZnSO4 + H2S; FeS + H2SO4 ---> FeSO4 + H2S
b) Gọi x, y là số mol Zn và Fe: 65x + 56y = 3,72 và x + y = 1,344/22,4 = 0,06
Giải hệ: x = 0,04; y = 0,02 ---> mZn = 65.0,04 = 2,6 g; mFe = 56.0,02 = 1,12 g.
a)Phương trình:
Zn+S→ZnS; Fe+S→FeS
ZnS+H2SO4→ZnSO4+H2S
FeS+H2SO4→FeSO4+H2S
b)Gọi m, m' là khối lượng Zn, Fe trong hỗn hợp ban đầu
m+m' = 3,72
nH2S=nZnS+nFeS=nZn+nFe=m/65+m'/56
=1,344/22,4=0,06
Bấm máy giải hệ phương trình:
m+m' = 3,72
(1/65).m+(1/56).m' = 0,06
ta được nghiệm: m = 2,6 ; m' = 1,12

nFe = 11.2/56 = 0.2 (mol)
Fe + S -to-> FeS
0.2________0.2
FeS + H2SO4 => FeSO4 + H2S
0.2____________________0.2
VH2S = 0.2*22.4 = 4.48 (l)
\(Fe+S\underrightarrow{t^o}FeS\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(FeS+H_2SO_4\rightarrow FeSO_4+H_2S\)
\(\Rightarrow V_{H_2S}=0,2.22,4=4,48l\)





a)Phương trình:
Zn+S→ZnS; Fe+S→FeS
ZnS+H2SO4→ZnSO4+H2S
FeS+H2SO4→FeSO4+H2S
b)Gọi m, m' là khối lượng Zn, Fe trong hỗn hợp ban đầu
m+m' = 3,72
nH2S=nZnS+nFeS=nZn+nFe=m/65+m'/56
=1,344/22,4=0,06
Bấm máy giải hệ phương trình:
m+m' = 3,72
(1/65).m+(1/56).m' = 0,06
ta được nghiệm: m = 2,6 ; m' = 1,12VV
lớp mấy đây trời
fe:1,12