Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phản ứng nhiệt nhôm:
2 A l + F e 2 O 3 → t 0 A l 2 O 3 + 2 F e ( 1 )
Phần 1 tác dụng với dung dịch NaOH dư không sinh ra khí → hỗn hợp B không có Al dư. Vậy hỗn hợp B gồm A l 2 O 3 , Fe và có thể có F e 2 O 3 dư.
4,4 gam chất rắn không tan có thể gồm Fe và F e 2 O 3 d ư
Phần 2: tác dụng với H 2 S O 4 loãng dư → chỉ có Fe phản ứng sinh ra khí
n H 2 = 1,12 22,4 = 0,05
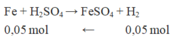
Khối lượng F e 2 O 3 dư ở phần 2 = 4,4 – mFe = 4,4 – 0,05.56 = 1,6 gam.
n F e 2 O 3 p u b d đ = 2. 1 2 . n F e ( p 2 ) = 0,05 m o l
Khối lượng F e 2 O 3 ban đầu: 0,05.160 + 1,6.2 = 11,2 gam.
⇒ Chọn B.

n HCl = 360 x 18,25/(100x36,5) = 1,8 mol
H 2 + CuO → t ° Cu + H 2 O
n CuO = x
Theo đề bài
m CuO (dư) + m Cu = m CuO (dư) + m Cu p / u - 3,2
m Cu = m Cu p / u - 3,2 => 64x = 80x - 3,2
=> x= 0,2 mol → m H 2 = 0,4g
Fe + 2HCl → FeCl 2 + H 2
Số mol HCl tác dụng với Fe 3 O 4 , Fe 2 O 3 , FeO là 1,8 - 0,4 = 1,4 mol
Phương trình hóa học của phản ứng:
Fe 3 O 4 + 8HCl → 2 FeCl 3 + FeCl 2 + 4 H 2 O (1)
Fe 2 O 3 + 6HCl → 2 FeCl 3 + 3 H 2 O (2)
FeO + 2HCl → FeCl 2 + H 2 O (3)
Qua các phản ứng (1), (2), (3) ta nhận thấy n H 2 O = 1/2 n HCl = 1,4:2 = 0,7 mol
Áp dụng định luật bảo toàn khối lượng, ta có:
m hỗn hợp + m HCl = m muối + m H 2 O + m H 2
57,6 + 1,8 x 36,5 = m muối + 0,7 x 18 +0,4
m muối = 57,6 + 65,7 - 12,6 - 0,4 = 110,3 (gam)

M g + 2 F e C l 3 → M g C l 2 + 2 F e C l 2 (1)
M g + 2 H C l → M g C l 2 + H 2 (2)
Từ phản ứng (2) ta có:
n M g = n H 2 = 2,688/22,4 = 0,12 mol
Dung dịch Y gồm 3 muối ⇒ M g C l 2 , F e C l 2 , F e C l 3 ⇒ F e C l 3 sau phản ứng (1) còn dư.
⇒ n F e C l 3 (1) = 2.nMg = 2.0,12 = 0,24g
F e + 2 F e C l 3 → 3 F e C l 2 (3)
⇒ n F e C l 3 (3) = 2 n F e = 0,04 mol
⇒ n F e C l 3 b d = n F e C l 3 ( 3 ) + n F e C l 3 ( 1 )
= 0,04+0,24 = 0,28g
⇒ m X = 0,12.24 + 0,28.(56+35,5.3) = 48,3g
⇒ Chọn C.

- Phần 1: \(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\)
PTHH:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
a--------------------------->1,5a
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b--------------------------->b
\(\Rightarrow1,5a+b=0,06\left(1\right)\)
- Phần 2: Đặt hệ số tỉ lệ \(\dfrac{P_2}{P_1}=k\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=ak\left(mol\right)\\n_{Fe}=bk\left(mol\right)\end{matrix}\right.\Rightarrow ak+bk=0,15\left(2\right)\)
\(n_{H_2}=\dfrac{2,016}{22,4}=0,09\left(mol\right)\)
PTHH: \(2Al+2KOH+2H_2O\rightarrow2KAlO_2+3H_2\)
0,06<----------------------------------------0,09
\(\Rightarrow ak=0,06\left(3\right)\)
Từ \(\left(1\right),\left(2\right),\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,02\\b=0,03\\k=3\end{matrix}\right.\)
\(\Rightarrow m=\left(0,02.27+0,03.56\right)\left(3+1\right)=8,88\left(g\right)\)






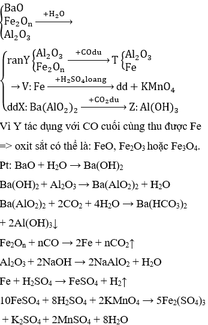


Phần 1 :
Vì CuO và ZnO không tan trong nước nên ta có :
PTHH :
(1) Na2O + H2O \(\rightarrow\) NaOH
Vì ZnO là oxit lưỡng tính nên nó sẽ phản ứng với NaOH
(2) ZnO + 2NaOH \(\rightarrow\) Na2ZnO2 + H2O
=> mCuO = 3,2 (g) => nCuO = \(\dfrac{3,2}{80}=0,04\left(mol\right)\)
Phần 2 : Theo đề bài ta có : nH2SO4 = \(0,5.0,2=0,1\left(mol\right)\)
Ta có pTHH :
(1) Na2O + H2SO4 \(\rightarrow\) Na2SO4 + H2O
(2) ZnO + H2SO4 \(\rightarrow\) ZnSO4 + H2O
(3) CuO + H2SO4 \(\rightarrow\) CuSO4 + H2O
0,04mol.......0,04mol
Ta có : nH2SO4(1) + nH2SO4(2) + nH2SO4(3) = 0,1
=> nH2SO4(1) + nH2SO4(2) = nH2SO4 - nH2SO4(3) = 0,1-0,04 = 0,06 (mol)
=> nZnO + nNa2O =0,06 (moL)
Phần 3 :
Theo đề bài ta có : nCO2 = \(\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Vì chỉ có những oxit của kim loại từ Zn -----> Cu mới tác dụng được với CO
Ta có PTHH :
\(\left(1\right)ZnO+CO-^{t0}\rightarrow ZnO+CO2\)
(2) \(CuO+CO-^{t0}\rightarrow Cu+CO2\)
0,04mol.....................................0,04mol
=> nCO2(1) = 0,06-0,04 = 0,02(mol)
=> nZnO = 0,02 (mol)
=> nNa2O = 0,06 - nZnO = 0,06-0,02 = 0,04 (mol)
Ta có :
mX = mNa2O + mZnO + mCuO = 3.(0,04.62 + 0,02.81 + 0,04.80) = 21,9 (g)
Ta có : \(\left\{{}\begin{matrix}\%mNa2O=\dfrac{3\left(0,04.62\right)}{21,9}.100\%\approx33,973\%\\\%mZnO=\dfrac{3\left(0,02.81\right)}{21,9}\approx22,192\%\\\%mCuO=100\%-33,973\%-22,192\%=43,835\%\end{matrix}\right.\)
Vậy.................