Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

CT chung A+2nH2SO4-->A2(SO4)n+nSO2+2nH2O
0.035/n 0.035 (mol)
A2(SO4)n-->A2On
0.035/n 0.035/n
mr=mA+(0.035/n)*n*16=2g
trắc nghiệm nSO42-=nSO2=0.035
BTĐT( chất rắn nên tự luận ko ghi được):nO2-=nSO42-=0.035
mr=mA+mO2-=2
A+2nH2SO4-->A2(SO4)n+nSO2+2nH2O
0.035/n 0.035 (mol)
A2(SO4)n-->A2On
0.035/n 0.035/n
mr=mA+(0.035/n)*n*16=2g
trắc nghiệm nSO42-=nSO2=0.035
BTĐT( chất rắn nên tự luận ko ghi được):nO2-=nSO42-=0.035
mr=mA+mO2-=2
#GG



Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3

a) Nhận xét: 33,84g X > 16g rắn → kim loại còn dư.
Chú ý: sau một thời gian ám chỉ các chất tham gia đều dư.
Giả sử số mol của Mg, Fe lần lượt là x, y
Tăng giảm khối lượng: (64 – 24) . x + (64 – 56) . y = 38,24 – 33,84 (1)
Chất rắn bao gồm MgO: x; Fe2O3: 0,5y; CuO: a – x – y
=> 40x + 160 . 0,5y + 80(a – x – y) = 16 (2)
Từ (1) và (2) => 10a + y = 2,55
amax <=> y = 0 => amax = 0,255
b) giá trị a đạt max thì Fe chưa tham gia pứ.
Giả sử số mol Mg dư là: z (mol) 19,12g Z cho 0,48 mol SO2 → 38,24g Z cho 0,96 mol SO2
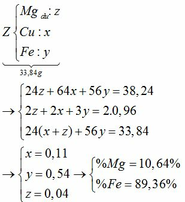

Bài giải:
2Fe + 6H2SO4 -> Fe2(SO4)3 + 3SO2 + 6H2O
2Al + 6H2SO4 -> Al2(SO4)3 + 3SO2 + 6H2O
Cu + 2H2SO4 -> CuSO4 + SO2 + 2H2O
(chú ý là H2SO4 đặc, nóng sẽ khử kim loại tạo muối sunfat kim loại có hóa trị cao nhất)
Lượng 3 muối sunfat = 45,1.2 = 90,2 gam và số mol SO2 = 0,7 mol
Fe2(SO4)3 + 6NaOH -> 2Fe(OH)3 + 3Na2SO4
Al2(SO4)3 + 6NaOH -> 2Al(OH)3 + 3Na2SO4
CuSO4 + 2NaOH -> Cu(OH)2 + Na2SO4
Al(OH)3 + NaOH -> NaAlO2 + H2O
Kết tủa lọc được chỉ còn Fe(OH)3 và Cu(OH)2
2Fe(OH)3 -> Fe2O3 + 3H2O
Cu(OH)2 -> CuO + H2O
12.2 = 24 (gam) là tổng lượng 2 oxit Fe2O3 + CuO
Gọi x, y, z lần lượt là số mol của Fe, Al, Cu
Ta có hệ 3 phương trình:
1,5x + 1,5y + z = 0,7
200x + 171y + 160z = 90,2
80x + 80z = 24
Giải hệ cho x = 0,2 ; y = 0,2 ; z = 0,1
Suy ra khối lượng mỗi kim loại trong hỗn hợp ban đầu: mFe = 11,2 g ; mAl = 5,4 g ; mCu = 6,4 g
\\ok//




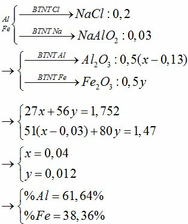


Gọi x,y lần lượt là số mol Mg, Fe
Mg + S ⟶ MgS
Fe + S ⟶ FeS
MgS + 4H2SO4 → MgSO4 + 4H2O + 4SO2
2FeS + 10H2SO4 → Fe2(SO4)3 + 9SO2 + 10H2O
S + 2H2SO4 → 3SO2 + 2H2O
Ta có :
\(\left\{{}\begin{matrix}Mg:x\left(mol\right)\\Fe:y\left(mol\right)\end{matrix}\right.\underrightarrow{+S:0,5\left(mol\right)}\left\{{}\begin{matrix}MgS:x\left(mol\right)\\FeS:y\left(mol\right)\\S_{dư}:0,5-\left(x+y\right)\left(mol\right)\end{matrix}\right.\underrightarrow{+H_2SO_4}\left\{{}\begin{matrix}MgSO_4:x\left(mol\right)\\Fe_2\left(SO_4\right)_3:\dfrac{y}{2}\left(mol\right)\\SO_2\end{matrix}\right.\underrightarrow{+NaOH\left(dư\right)}\left(kt\right)\left\{{}\begin{matrix}Mg\left(OH\right)_2:x\left(mol\right)\\Fe\left(OH\right)_3:y\left(mol\right)\end{matrix}\right.\underrightarrow{to}\left\{{}\begin{matrix}MgO:x\left(mol\right)\\Fe_2O_3:\dfrac{y}{2}\left(mol\right)\end{matrix}\right.\)
Ta có :\(n_{SO_2}=4x+4,5y+\left[0,5-\left(x+y\right)\right].3=2\left(mol\right)\)
\(40x+160\dfrac{y}{2}=24\)
=> \(\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
=> \(m_{Mg}=0,2.24=4,8\left(g\right)\)
\(m_{Fe}=0,2.56=11,2\left(g\right)\)
\(m=4,8+11,2=16\left(g\right)\)
\(\%m_{Mg}=\dfrac{4,8}{16}.100=30\%\)
\(\%m_{Fe}=100-30=70\%\)