Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,6\cdot0,4+0,6\cdot0,3\cdot2=0,6\left(mol\right)\\n_{H^+}=0,2\cdot2,6=0,52\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) H+ hết, OH- còn dư \(\Rightarrow n_{OH^-\left(dư\right)}=0,08\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,08}{0,6+0,2}=0,1\left(M\right)\) \(\Rightarrow pH=14+log\left(0,1\right)=13\)
Bài 2:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,3\cdot1,6=0,48\left(mol\right)\\n_{H^+}=0,2\cdot1\cdot2+0,2\cdot2=0,8\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) OH- hết, H+ còn dư \(\Rightarrow n_{H^+\left(dư\right)}=0,32\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,32}{0,2+0,3}=0,64\left(M\right)\) \(\Rightarrow pH=-log\left(0,64\right)\approx0,19\)

a) \(n_{H^+}=n_{HCl}+2n_{H_2SO_4}=0,1\cdot0,12+0,1\cdot0,04=0,016\)
\(C_M=\dfrac{0,016}{0,2}=0,08M\)
\(\Rightarrow pH=-log\left(0,08\right)=1,1\)
b) \(n_{OH^-}=n_{KOH}+2n_{Ba\left(OH\right)_2}=0,012+2\cdot0,004=0,02\)
\(C_M=\dfrac{0,02}{0,2}=0,1\)
\(\Rightarrow pH=-log\left(\dfrac{10^{-14}}{0,1}\right)=13\)

`100mL=0,1L`
`n_{H^+}=0,1.0,05.2+0,1.0,1=0,02(mol)`
`n_{SO_4^{2-}}=0,1.0,05=0,005(mol)`
`n_{OH^-}=0,1.0,2+0,1.0,1.2=0,04(mol)`
`n_{Ba^{2+}}=0,1.0,1=0,01(mol)`
`Ba^{2+}+SO_4^{2-}->BaSO_4`
Do `0,01>0,005->` Tính theo `SO_4^{2-}`
`n_{BaSO_4}=n_{SO_4^{2-}}=0,005(mol)`
`->m_↓=0,005.233=1,165(g)`
`H^{+}+OH^{-}->H_2O`
Do `0,02<0,04->OH^-` dư
`n_{OH^{-}\ pu}=n_{H^+}=0,02(mol)`
`->n_{OH^{-}\ du}=0,04-0,02=0,02(mol)`
Trong X: `[OH^-]={0,02}/{0,1+0,1}=0,1M`
`->pH=14-pOH=14+lg[OH^-]=13`

Đáp án B
nOH- = 0,1.2.0,1 + 0,1.0,1 = 0,03
nH+ = 0,4.2.0,0375 + 0,4.0,0125 = 0,035
⇒ Trong X có H+ dư
⇒ nH+/X =0,035 – 0,03 = 0,005; VX = 100 + 400 = 500ml
⇒ [H+] = 0,01 ⇒ pH = 2.

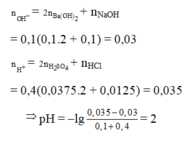
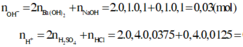
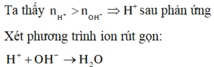
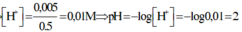

Giúp mình câu này với nhe mn❤