Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi a là số mol của lá nhôm tham gia p/ứ:
PTHH:
2Al + 3 CuSO4 \(\rightarrow\)Al(SO4)3 + 3 Cu
a mol\(\rightarrow\)\(\frac{3}{2}\)a mol \(\rightarrow\) \(\frac{3}{2}\)a mol
Theo đề bài cho độ tăng KL của lá nhôm sau p/ứ là:
mCu bám - mal tan = \(\frac{3}{2}\)62a - 27a= 1,38
\(\Rightarrow\)a= 0,02 mol
a) Khối lượng nhôm tham gia phản ứng:
m= n x M = 0,02 x 27 = 0,54 g
b) Khối lượng đồng sunfat trong dung dịch
m = n x M = \(\frac{3}{2}\)0,02 x 160= 4,8 g

Fe + CuSO4 = FeSO4 + Cu
Sau phản ứng khối lượng thanh sắt tăng lên, chứng tỏ có 1 lượng Cu bám lên thanh sắt.
Khối lượng Cu phản ứng là: 16,4 - 15,6 = 0,8 (g)
Số mol Cu là: 0,8 : 64 = 0,0125 (mol)
Theo PTHH: n Fe= nCu = 0,0125 (mol)
Khối lượng sắt tham gia phản ứng là: 0,0125 x 56 = 0,7(g)

2 A l + 3 C u S O 4 → A l 2 S O 4 3 + 3 C u
2x……3x…….x…3x (Mol)
Theo bài ta có:
m C u b á m v à o - m A l tan = m A l t ă n g
⇔ 3x.64 -2x.27 = 1,38 ⇔ 138x = 1,38
⇔ x = 0,01 mol
⇒ n C u S O 4 = 3x = 3.0,01 = 0,03 mol
⇒ C M C u S O 4 = 0,03/0,2 = 0,15 mol
⇒ Chọn B.

Gọi x là số mol của Cu
2Al + 3CuSO4------>Al2(SO4)3 + 3Cu
x--------------------------------------->3/2x
96x-27x=1.38
69x =1.38
x =0.02
mAl=0,02.27=0.54g

* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư. Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = .100% ≈ 9,32%
C%, FeSO4 = .100% ≈ 5,45%
* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư.
Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
1 mol Fe phản ứng thì khối lượng sắt tăng: 64-56 = 8 gam
x mol Fe → 2,58 -2,5 = 0,08 gam
⇒ x = 0,01 mol
b) Số mol CuSO4 ban đầu
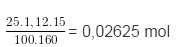
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:



Đáp án C.
Gọi khối lượng miếng Al là a gam, lượng nhôm đã phản ứng là x gam :
2Al + 3 CuSO 4 → Al 2 SO 4 3 + 3 Cu
Gọi x là khối lượng Al phản ứng.
So với khối lượng miếng Al ban đầu thì khối lượng miếng Al sau phản ứng tăng 1,38 gam.