Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi m i , rrn là khối lượng khí trong bình trước và sau khi nung nóng bình.
Áp dụng phương trình Menđêlêep - Clapêrôn ta có:
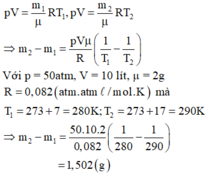

Gọi m1, m2 là khối lượng khí trong bình trước và sau khi nung nóng bình. Áp dụng phương trình Menđêlêep – Clapêrôn ta có:
p V = m 1 μ R T 1 , p V = m 2 μ R T 2 . ⇒ m 2 − m 1 = p V μ R ( 1 T 1 − 1 T 2 )
Với p = 50atm, V = 10 lít, μ = 2 g
R = 0 , 082 ( a t m . l / m o l . K ) Mà T 1 = 273 + 7 = 280 K ; T 2 = 273 + 17 = 290 K
⇒ m 2 − m 1 = 50.10.2 0 , 082 ( 1 280 − 1 290 ) m 2 - m 1 = 1 , 502 ( g )

a)
Cứ N A phân tử (nguyên tử) He có khối lượng 4g.
Chú ý: N = 3 , 01.10 23 = N A 2
⇒ khối lượng He trong bình: m = 4 2 = 2 g
b)
Trong điều kiện nhiệt độ và áp suất như trên (ĐKTC),
thể tích của 1 mol He là V 0 = 22,1 lít. Vì lượng khí He
trong bình chỉ là 0,5 mol nên thể tích của bình là:
V = V 0 2 = 11 , 2 lít.

Xét lượng khí trong bình.
Trạng thái đầu: V 1 = 8 lít; T 1 = 100 + 273 = 373 K ; p 1 = 10 5 N/ m 2
Trạng thái cuối: V 2 = 8 lít; T 2 = 20 + 273 = 293 K; p 2 = ?
Vì thể tích không đổi nên:
p 1 / T 1 = p 2 / T 2 ⇒ p 2 = p 1 T 2 / T 1 = 7,86. 10 4 N/ m 2

Gọi \(m_1;m_2\) là khối lượng khí trong bình trước và sau khi đun nóng bình. Áp dụng phương trình Menđêlêep - Clapêrông ta có: \(pV=\frac{m_1}{\mu}RT_1;pV=\frac{m_2}{\mu}RT_2\)
Từ đó suy ra khối lượng khí đã thoát ra:
\(m_2-m_1=\frac{pV\mu}{R}\left(\frac{1}{T_1}-\frac{1}{T_2}\right)\), với \(p=50atm,V=10\)lít \(,\mu=2g\)
\(R=0,084atm.l\text{/}mol.K;\)\(T_1=7+273=280K\)
\(T_2=17+273=290K\). Suy ra \(m_2-m_1=1,47g\)
Gọi m1,m2m1,m2 là khối lượng khí trong bình trước và sau khi đun nóng bình. Áp dụng phương trình Menđêlêep - Clapêrông ta có: pV=m1μRT1,pV=m2μRT2pV=m1μRT1,pV=m2μRT2
Từ đó suy ra khối lượng khí đã thoát ra:
m2−m1=pVμR(1T1−1T2)m2−m1=pVμR(1T1−1T2), với p=50atm,V=10lít,μ=2gp=50atm,V=10lít,μ=2g
R=0,084atm.l/mol.K;T1=7+273=280KR=0,084atm.l/mol.K;T1=7+273=280K
T2=17+273=290KT2=17+273=290K. Suy ra m2−m1=1,47g

Chọn B.
Ban đầu, lúc chưa làm thoát khí ta có:
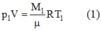
Khi làm thoát khí, lượng khí còn lại trong bình là
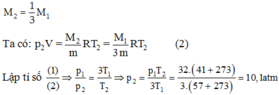

Cần tác dụng vào nắp một lực thằng được trọng lượng của nắp và lực gây ra bởi sự chênh lệch áp suất giữa không khí bên ngoài và bên trong bình:
F = mg + S( p 1 - p 2 ) = mg + π d 2 /4( p 1 - p 2 ) = 692N



Đáp án A
Gọi
lần lượt là khối lượng ôxi trong bình nước và sau khi dùng:
Mặt khác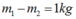
suy ra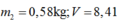
Ghi chú: khi giải bài này ta đã coi khí ôxi ở áp suất 150 atm vẫn là lí tưởng, vì thế kết quả chỉ gần đúng (sai lệch có thể đến cỡ 5%)